La revue SOLDATS DU FEU a organisé du 19 au 21 mars 2025 les Journées Thématiques. Plus de 100 délégués participaient à l’évènement. 3F était présent sur le stand de son distributeur JCM pour ses émulseurs sans fluor et additifs pour feux de classe A.
Un des thèmes abordés a été les nouveaux émulseurs sans fluor dits F3. Le Dr. Thierry Bluteau, expert chimiste de LEIA Ltd, est revenu sur les problèmes rencontrés avec les F3, comme la viscosité ‘’trop’’ élevée, l’instabilité au stockage et la sensibilité à l’eau. Il a évoqué les solutions apportées par les fabricants innovants, tel 3F. L’évènement a été un franc succès et a confirmé le mouvement de la profession vers des produits performants et respectueux de l’environnement.
Actualités
Journées Thématiques à Troyes – France du 19 au 21 Mars 2025
Des AFFF aux F3 : les F3 sont créés — Partie 6
Dans les articles précédents (partie 1 à 5) nous avons traité l’Histoire, la Chimie, L’Impact sur la Santé et l’Environnement et la Réglementation pour les produits contenant des PFCs.
Introduction
Depuis le retrait de 3m de la chimie du fluor en 2000 jusqu’au marché actuel, un nombre croissant de fabricants ont présenté des émulseurs sans fluor. Si aujourd’hui, les fabricants disent que les F3 sont une évidence voire une obligation, cela n’a pas été toujours le cas depuis les années 2000 !
Les premières années 2000-2012
En réalité, pendant plus de 12 ans, seulement 2 chimistes – nommés Ted Shaeffer et Thierry Bluteau -, se sont réellement intéressés et ont travaillé pour proposer la première génération de F3, respectivement RE-Healing Foam (Solberg) et ECOPOL (BIO-EX). Ces premiers F3 étaient très performants sur feux de solvants polaires, mais présentaient des faiblesses sur les feux d’hydrocarbures.
Pendant ces années, la bataille faisait rage entre ces deux sociétés pionnières et leurs concurrents – regroupés sous la bannière FFFC – à propos de maintien ou pas de la technologie AFFF sur le marché. Malgré tous leurs efforts pour miner la technologie F3, le changement était en marche et de nombreux utilisateurs avaient décidé de changer pour un émulseur ‘’vert’’ et efficace.
Les dernières années 2012-2024
Cette période peut être considérée comme une transition, quand il est devenu indéniable que les F3 deviendraient les émulseurs du futur et les AFFF des produits du passé. Cette période a éveillé la conscience des utilisateurs et des fabricants et en quelques années la deuxième génération des F3. La principale avancée est la performance améliorée sur feux d’hydrocarbures, les produits annonçaient des performances maximales selon les normes EN 1568-3 et UL162. Les chimistes ont changé : Thierry Bluteau est conseil auprès de 3FFF Ltd et Ted Shaeffer est à la retraite. D’autres chimistes se sont attelés à la création des F3.
La technologie F3
Le chimiste a dû résoudre un problème de taille : le retarit de la formule des molécules perfluorées a signifié la nécessité d’utiliser une composé/mélange chimique combinant des propriétés extinctrices similaires, à savoir la résistance à la chaleur et à la contamination par le carburant.
Nous avons vu dans les articles précédents que les formules synthétiques sont basées sur l’association de tensio-actifs, de solvants et de polymères. Le choix est vaste pour le chimiste.
– Plus de 7000 tensio-actifs sont répertoriés
– Nous comptons entre 800 et 1000 solvants hydrophiles
– Pour les polymères, le choix est immense, probablement plus de 1000 classes de polymères existent, sans compter les nombreux copolymères et les variations de longueur et de ramification.
Il est possible d’apprécier la difficulté pour le chimiste à sélectionner parmi tous ces produits pour aboutir au produit final.
La formule adéquate pour un émulseur est l’équilibre entre les différents composants pour obtenir une performance extinctrice satisfaisante, tout en maintenant des caractéristiques satisfaisantes, telles que la densité, le pH, la viscosité, le foisonnement, le temps de décantation et la stabilité au vieillissement.
Hélas, l’emploi en excès de polymères entraine une augmentation importante de la viscosité, ce qui rend certains émulseurs impossibles à doser avec des proportionneurs classiques. Certains fabricants de doseurs ont dû modifier leur système d’injection pour prendre en compte cette viscosité élevée ; et dans certains cas, certains émulseurs ont juste impossibles à utiliser dans la pratique.
Nous avons vu que, même si les meilleurs F3 sont comparables en performance aux AFF, ils sont très visqueux et nécessitent l’emploi de doseurs spécifiques – et coûteux. Cela entraine un cout annexe imprévu qui en final augmente l’ensemble de l’équipement anti-incendie.
En dehors de la viscosité qui est un problème majeur, la majorité des F3 contiennent des quantités élevées de solvants – principalement des glycols et éthers de glycols – aux effets toxiques potentiels. Ces solvants migrent et pénètrent la peau, ce qui provoque des risques d’allergie, d’irritation/sensibilité cutanée, et d’autres effets sur la santé une fois dans le sang.
La troisième génération des F3
La société 3F s’est consacrée depuis ses débuts à proposer des produits F3 conçus pour répondre parfaitement aux besoins de l’utilisateur. Cette philosophie est ancrée dans son génome, 3F offre une gamme complète de F3 – sous la marque FREEGEN – pour répondre aux besoins du marché.
C’est pourquoi 3F a développé une technique exclusive et offre les émulseurs SMART FOAM ® ; cette technologie permet d’éliminer complètement les solvants de la formulation. De plus, 3F a mis au point une combinaison permettant de contrôler la viscosité finale de l’émulseur tout en maintenant un haut niveau de performance sur feux. C’est ainsi que 3F propose 2 SMART FOAM FREEGEN SF-LV et FREEGEN ULTRA utilisables avec tous les doseurs du marché – même avec un simple doseur de type Venturi.
CONCLUSION
La technologie F3 est facilement disponible et a démontré son efficacité. Grâce au support de la réglementation, l’industrie est déjà en cours de remplacement du stock d’AFFF par des F3. Les F3 sont en cours de développement pour offrir encore plus de possibilité, en termes de concentration d’emploi, foisonnement, efficacité, etc… Au moment du choix, le décideur et/ou chef des pompiers doit vérifier que l’émulseur est compatible avec ses besoins et son matériel, et répond aux critères de performances exigés (LastFire, VDS, EN, OACI,…)
Des AFFF aux F3 : Réglementation et pressions législatives — Partie 5
Les articles précédents (parties 1 à 4) ont traité de l’histoire, de la chimie, des impacts environnementaux et sanitaires de l’exposition aux PFAS.
Introduction
Les régulateurs sont de plus en plus conscients des risques impliqués par la fabrication et l’utilisation de composés perfluorés dans les produits industriels et de consommation et, par conséquent, de nombreux pays ont promulgué une législation restreignant l’utilisation et l’élimination des PFAS.
Le manque de connaissance des meilleures pratiques disponibles (BAP) ou de la loi ne constitue pas un moyen de défense lorsqu’il s’agit de défendre des actions susceptibles d’avoir conduit à une contamination de l’environnement, comme le résume la phrase juridique « ignorantia legis neminem excusat ‘’ (l’ignorance de la loi n’excuse personne). Cette doctrine apparaît pour la première fois dans la Bible dans Lévitique 5 : 17 : « Si quelqu’un pèche et fait ce qui est interdit dans l’un des commandements du Seigneur, même s’il ne le sait pas, il est coupable et sera tenu responsable. »
Une interprétation moderne de ce principe a été établie dans le cadre de la Convention de Rio en 1992, comme le principe de précaution selon lequel l’absence de preuves ne doit pas être considérée comme une preuve de l’absence de préjudice, en particulier lorsque des effets intergénérationnels à long terme peuvent être suspectés.
Les séminaires REEBOK
Peu de temps après l’annonce par la société 3M en mai 2000 de son retrait de la chimie à base de PFOS, RAK et ses collègues ont organisé une série de conférences internationales à Manchester et à Bolton pour discuter des problèmes environnementaux associés aux mousses anti-incendie. Ces séminaires Reebok, qui ont eu lieu en 2002, 2004, 2007, 2009 et 2013, ont attiré un grand nombre de représentants de l’industrie des produits fluorés, des régulateurs, des fabricants de mousse et des utilisateurs finaux tels que les services d’incendie du monde entier. Ces séminaires sont devenus le forum de facto de l’industrie pour discuter de l’élimination progressive des AFFF de classe B et de la transition vers les mousses sans fluor de classe B (F3).
Lors du premier séminaire Reebok en 2002, il a été souligné que la réglementation britannique sur les eaux souterraines de 1998 interdisait déjà le rejet de produits chimiques fluorés présents dans les mousses AFFF dans les eaux souterraines s’ils étaient PBT – persistants, bioaccumulables et toxiques. Malheureusement, étant donné le manque évident de connaissance de la signification du terme « organohalogéné » dans le règlement (SI 2746/1998), il a été dit que celui-ci n’était pas pertinent.
Les séminaires Reebok ultérieurs, en particulier en 2004 et 2007, se sont concentrés non seulement sur le PFOS, mais également sur le PFOA et les substances apparentées qui pourraient se dégrader en PFOA, un produit final typique de dégradation des PFCA perfluorés extrêmement persistants. La possibilité que des dérivés tels que le 8 :2FTS, tels que ceux trouvés dans les mousses de fluorotélomères C6/C8, se biodégradent pour produire du PFOA a d’abord été vigoureusement niée par l’industrie fluorochimique face aux preuves publiées suggérant le contraire. Cependant, la teneur entière de la discussion a changé à la suite des pressions exercées par l’EPA des États-Unis, qui ont abouti au programme de gestion du PFOA 2010-2015, qui a finalement abouti à l’exigence que les produits fluorotélomères contiennent moins de 25 ppb de PFOA ou de ses précurseurs.
i) 1998 : Sous réserve de l’alinéa (2) ci-dessous, une substance est dans la liste I si elle appartient à l’une des familles ou groupes de substances suivants :
a) les composés organohalogènes et les substances susceptibles de former de tels composés dans le milieu aquatique ;
ii) 2009 : Cela inclut notamment les éléments suivants lorsqu’ils sont toxiques, persistants et susceptibles de bioaccumulation :
a) les composés organohalogénés et les substances susceptibles de former de tels composés dans le milieu aquatique ;
UBA
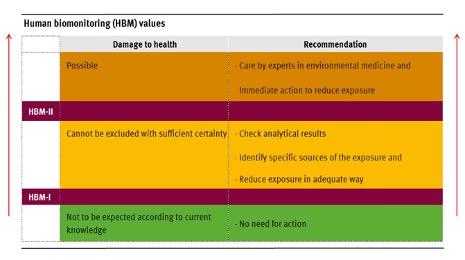
La Commission de biosurveillance humaine de l’Agence fédérale allemande de l’environnement (das Umweltbundesamt ou UBA) a établi des niveaux déclencheurs pour le PFOS et le PFOA dans le plasma sanguin humain. La valeur HBM-I est la concentration plasmatique en ng/l (ppb) qui, selon les estimations, ne présente aucun risque appréciable pour la population humaine en cas d’exposition prolongée et, par conséquent, ne nécessite aucune mesure supplémentaire. Les concentrations entre HBM-I et HBM-II indiquent que les impacts sur la santé ne peuvent être exclus avec suffisamment de certitude et qu’une enquête plus approfondie est nécessaire avec l’introduction de mesures pour éliminer, réduire ou contrôler l’exposition, y compris l’identification des sources potentielles et la vérification des résultats d’analyse. Les concentrations plasmatiques supérieures aux valeurs HBM-II, indiquant des impacts possibles sur la santé, nécessitent une intervention immédiate pour réduire ou éliminer l’exposition et une évaluation de tout impact sur la santé.
Les valeurs HBM-I et HBM-II pour le PFOS et le PFOA sont indiquées ci-dessous. Pour les femmes en âge de procréer, les valeurs HBM-II recommandées sont la moitié de celles de la population générale. Il convient de noter que les valeurs du PFOA sont inférieures à celles du PFOS.

Exposition des pompiers
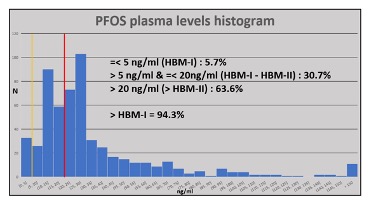
L’histoire des pompiers qui sont ou ont été professionnellement exposés aux AFFF à base de PFAS est une histoire assez différente. Les pompiers de longue date ainsi que ceux employés plus récemment peuvent avoir des taux plasmatiques bien supérieurs aux valeurs acceptables, en particulier pour le PFOS et son homologue PFHxS, qui sont corrélés. À titre d’exemple, la figure ci-dessous montre les niveaux plasmatiques de PFOS en 2015-2016 pour une vaste cohorte de pompiers d’une grande brigade de pompiers australienne, dans laquelle la majorité avaient des niveaux supérieurs au HBM-II. LE niveau HBM-I est indiqué par la ligne verticale jaune, HBM-II en rouge. Près des 2/3 de la cohorte échantillonnée dépassaient le HBM-II, ce qui indique un risque potentiel pour la santé.
La principale voie d’exposition des pompiers aux PFAS est clairement l’utilisation de mousse anti-incendie contenant des produits chimiques fluorés AFFF, que ce soit lors des opérations ou pendant la formation et la maintenance. Le mécanisme d’exposition est sans aucun doute soit l’inhalation d’aérosols moussants, en particulier pour le personnel ne portant pas d’appareil respiratoire autonome (ARI), soit l’absorption cutanée suite à l’immersion dans un aérosol de mousse. Lors de tout incident majeur impliquant de la mousse, par exemple un incendie dans un réservoir de carburant, environ un tiers de la mousse appliquée par les canons n’atteint jamais l’incendie lui-même mais est perdu sous forme de rideau de mousse et d’aérosol qui contamine la zone environnante et tout le personnel présent..

Eau potable
L’eau potable est la seule voie d’exposition inévitable pour tout le monde. L’apport moyen est calculé à environ 2 litres/jour au cours de la vie. Les apports hebdomadaires totaux maximaux (DHT) sont calculés sur cette base.
La directive révisée de l’UE sur l’eau potable est entrée en vigueur en janvier 2021, avec une conformité totale le 12 janvier 2023, et comprend des mesures visant à lutter contre les contaminants émergents tels que les perturbateurs endocriniens et les PFAS, ainsi que les microplastiques. La concentration maximale de tous les composés PFAS combinés est de 0,5 μg par litre d’eau (500 ppb). Alternativement, les États membres peuvent surveiller la somme de 20 composés PFAS spécifiés, pour lesquels le maximum est de 0,1 μg/l (100 ppb).
L’Institut national néerlandais pour la santé publique et l’environnement (RVIM) a récemment déterminé de nouvelles limites de risque pour les PFAS dans les eaux de surface [*2022-0074 RVIM 2022-09-08] sur la base des valeurs sanitaires dérivées de l’EFSA pour les PFAS en 2020. Les nouvelles limites de risque sont de 0,3 ng/l (0,3 ppt) pour le PFOA, de 7 pg/l (0,007 ppt) pour le PFOS et de 10 ng/l (10 ppt) pour le Gen-X. Celles-ci sont bien inférieures aux normes actuelles pour ces PFAS.
Produits alimentaires
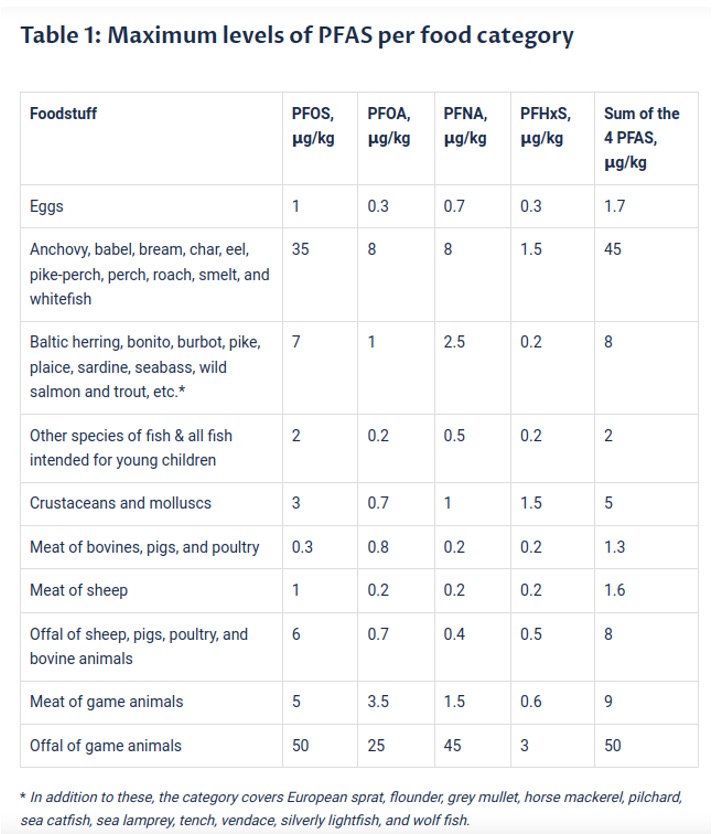
Les limites des PFAS dans certains produits alimentaires sur le marché de l’UE sont répertoriées dans le tableau 1. Si des concentrations plus élevées sont découvertes lors de tests en laboratoire, le produit doit être retiré du marché.
ONU – Convention de Stockholm pour les POP
Le Forum intergouvernemental sur la sécurité chimique (IFCS) et le Programme international sur la sécurité chimique (IPCS) ont préparé une évaluation des 12 pires substances, connues sous le nom de « sale douzaine », comme étant les premiers POP répertoriés dans les annexes de la Convention de Stockholm. Ces substances comprenaient les pesticides Aldrin, Chlordane, DDT, Dieldrin, Endrin, Heptachlore, Hexachlorobenzene HCB, Mirex, Toxaphene ; et des produits chimiques industriels, les biphényles polychlorés PCB, les dibenzo-p-dioxines polychlorées PCDD et les dibenzofuranes polychlorés PCDF.
Le CNI s’est réuni cinq fois entre juin 1998 et décembre 2000 pour élaborer la convention, et les délégués ont adopté la Convention de Stockholm sur les POP lors de la Conférence des plénipotentiaires convoquée en mai 2001 à Stockholm, en Suède. La convention est entrée en vigueur le 17 mai 2004 avec la ratification initiale de 128 parties et 151 signataires. Les cosignataires ont convenu d’interdire neuf des douze sales produits chimiques.
La première série de nouveaux produits chimiques à ajouter à la convention a été convenue lors d’une conférence à Genève le 8 mai 2009.
En 2009, l’acide perfluorooctane sulfonique et ses dérivés -PFOS- ont été inclus dans la Convention de Stockholm des Nations Unies pour éliminer leur utilisation (décision SC-4/17). En 2019, suite à l’évaluation par la POPRC-14 en 2018 au siège de la FAO à Rome du besoin continu de PFOS, de ses sels et dérivés, la COP9 a modifié l’Annexe B pour supprimer plusieurs des exemptions spécifiques et des objectifs acceptables pour le PFOS (décision SC-9/4).
• UNEP/POPS/POPRC.2/17/Add.5 : Profil de risque pour le sulfonate de perfluorooctane
• UNEP/POPS/POPRC.3/20/Add.5 : Évaluation de la gestion des risques liés au sulfonate de perfluorooctane
• UNEP/POPS/POPRC.4/15/Add.6 : Addendum à l’évaluation de la gestion des risques liés au sulfonate de perfluorooctane
En 2019, la COP9 a inscrit le PFOA et ses dérivés à l’Annexe A de la Convention de Stockholm (décision SC-9/12). Le Secrétariat du POPRC a élaboré une liste indicative de substances, contenant à l’origine environ 4 700 composés ; la liste doit être mise à jour périodiquement. Le PFOA est interdit par le règlement POP depuis le 4 juillet 2020.
• UNEP/POPS/POPRC.12/11/Add.2 : Profil de risque pour le PFOA, ses sels et les composés apparentés au PFOA.
• UNEP/POPS/POPRC.12/INF/5 : Informations supplémentaires relatives au profil de risque du PFOA, de ses sels et des composés apparentés au PFOA.
• UNEP/POPS/POPRC.13/7/Add.2 : Évaluation de la gestion des risques liés au PFOA, à ses sels et aux composés liés au PFOA.
• UNEP/POPS/POPRC.14/6/Add.2 : Addendum à l’évaluation de la gestion des risques liés au PFOA, à ses sels et aux composés liés au PFOA.
• UNEP/POPS/POPRC.17/INF/14/Rev.1 : Liste indicative mise à jour des substances couvertes par la liste du PFOA, de ses sels et des composés apparentés au PFOA.
En juin 2022, la Convention de Stockholm des Nations Unies a également décidé d’inclure le PFHxS et les composés associés dans le traité. La Commission a ajouté ce groupe de substances dans le règlement de l’UE sur les POP en mai 2023 et le règlement est entré en vigueur le 28 août 2023.
Le POPRC examine actuellement les PFCA à chaîne longue et les composés apparentés proposés pour inscription aux annexes de la Convention de Stockholm.
• UNEP/POPS/POPRC.17/7 : Proposition visant à inscrire les acides perfluorocarboxyliques à longue chaîne, leurs sels et composés apparentés dans les annexes A, B et/ou C de la Convention de Stockholm sur les polluants organiques persistants.
Livres blancs du panel d’experts IPEN PFAS 2018-2019
Trois livres blancs influents produits par le groupe d’experts de l’IPEN PFAS en 2018-2019, coordonnés par Roger Klein et ses collègues, ont été présentés au POPRC14 de la Convention de Stockholm des Nations Unies en 2018, à la COP9 et au POPRC15 en 2019 pour discuter des progrès réalisés dans la transition des mousses anti-incendie AFFF aux mousses anti-incendie F3, problèmes associés aux PFAS et PFHxS. Ces livres blancs ont aidé le Comité à parvenir à l’inscription de ces PFAS dans les annexes appropriées pour restriction ou interdiction en 2019 et 2022.
En septembre 2022, la Convention de Stockholm des Nations Unies comptait 186 parties (185 États et l’Union européenne). Les États non ratifiants notables comprennent les États-Unis, Israël et la Malaisie.
Règlement UE
Le premier produit à être réglementé a été le PFOS.
La Norvège a interdit l’utilisation de matériaux contenant du PFOS en 2007.
Le règlement de la Commission de l’Union européenne (n° 757/2010) exigeait que toute mousse contenant du PFOS au-dessus de 10 mg/kg (0,001 % p/p ou 10 ppm) ne soit pas utilisée après le 27 juin 2011 et a été adopté par l’Agence britannique pour l’environnement. en février 2011.
En janvier 2014, l’Agence norvégienne pour l’environnement a publié le règlement FOR-2013-05-27-550, qui interdit l’utilisation de l’acide perflurooctanoïque -PFOA- et de ses sels et esters.
Des limites ont été mises en œuvre le 1er juillet 2014 pour tous les produits fabriqués, importés, exportés et commercialisés en Norvège, à l’exception de certains articles spécifiques pour lesquels les nouvelles règles ont été appliquées le 1er janvier 2016.
En 2020, l’UE 2020/784 réglemente l’utilisation du PFOA et limite la teneur à 25 ppb. En théorie, il peut être utilisé jusqu’en 2025 si tous les effluents peuvent être confinés, ce qui est impossible à garantir. Dans les faits, la réglementation élimine le PFOA en Europe.
Les acides carboxyliques perfluorés à longue chaîne (PFCA en C9-14), leurs sels et leurs précurseurs sont restreints dans l’UE/EEE – Règlement UE 2021/1297 – à partir de février 2023.
L’Allemagne – soutenue par la Suède, les Pays-Bas, le Danemark et la Norvège – a proposé une restriction supplémentaire pour l’acide perfluorohexanoïque C6 -PFHxA-, ses sels et substances associées. Cette proposition est très importante car elle interdirait effectivement l’utilisation de mousses AFFF de fluorotélomères C6. Cette proposition a été évaluée par l’ECHA en décembre 2021.
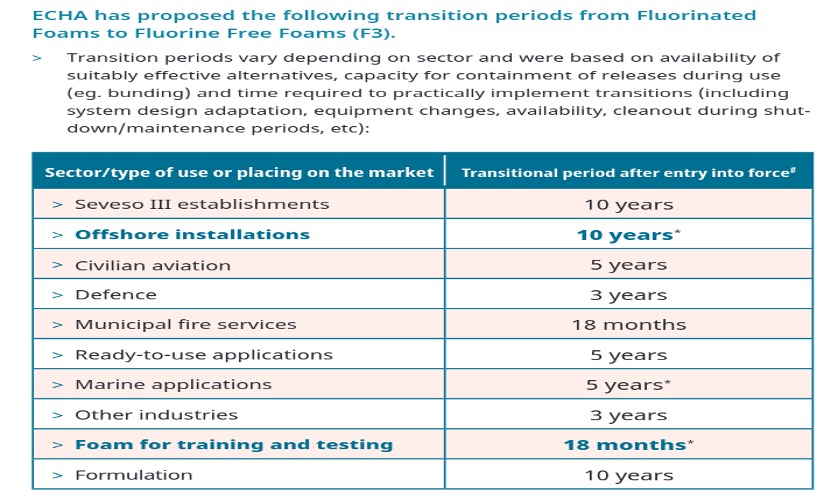
L’Agence européenne des produits chimiques -ECHA- évalue une restriction sur une interdiction des PFAS dans les mousses anti-incendie à l’échelle de l’UE. La restriction pourrait réduire les émissions de PFAS dans l’environnement d’environ 13 200 tonnes sur 30 ans [*juin 2023 ECHA/NR/23/19]. Une réponse devrait être donnée en janvier 2024.
AUSTRALIE
Jusqu’à récemment, il n’y avait pas d’approche fédérale pour réglementer l’utilisation des AFFF en Australie ; mais chaque État avait sa propre manière de restreindre l’utilisation des mousses fluorées.
Canberra – Fédéral – a publié en mai 2020 le NEMP 2.0 pour établir une base pratique pour des directives et des normes environnementales cohérentes à l’échelle nationale pour la gestion de la contamination par les PFAS. Une ébauche de restriction des PFAS dans NEMP 3.0 a été publiée en septembre 2022.
Queensland
Les pompiers du Queensland utilisent la mousse F3 depuis 2003
Les autorités environnementales du Queensland contrôlent la teneur en PFAS des produits AFFF et interdisent le PFOS.
Nouvelle Galles du Sud
Les services d’incendie utilisaient les mousses 3M ; et a arrêté leur utilisation en 2007. Le Règlement sur les opérations de protection de l’environnement 2022 interdit et restreint l’utilisation de mousse anti-incendie PFAS en Nouvelle-Galles du Sud afin de réduire son impact sur l’environnement, tout en autorisant son utilisation pour prévenir ou combattre les incendies catastrophiques par les autorités compétentes et exempter entités. Le règlement est conforme à la déclaration de position nationale sur les PFAS et constitue la première étape pour atteindre les objectifs convenus dans la déclaration.
Victoria
En 2007, le service d’incendie de Victoria – MFB – a pris la décision de remplacer la mousse anti-incendie existante par une mousse anti-incendie sans fluor. Cette décision a été prise sur la base de préoccupations liées à la santé des pompiers et aux enjeux environnementaux. MFB a élaboré une « politique d’utilisation opérationnelle de la mousse anti-incendie » qui a été formellement approuvée par l’Environmental Protection Authority (EPA), WorkSafe et la Country Fire Authority (CFA). En 2011, sur la base d’études scientifiques indépendantes sur les PFAS, qui ont identifié des liens avec divers cancers et autres problèmes de santé, MFB a effectué des essais approfondis et Fire Rescue Victoria a évalué diverses mousses anti-incendie sans fluor dans des scénarios d’incendie de liquide inflammable de classe B. MFB a constaté que la mousse sans fluor fonctionnait systématiquement bien pour éteindre les incendies de classe B et fournissait aux pompiers MFB un moyen d’extinction alternatif « plus sûr » éprouvé. Ce travail a fourni à MFB une solution opérationnelle de mousse anti-incendie qui pourrait être utilisée efficacement sur les sites du ministère de la Défense, tels que les bases aériennes de la RAAF à Point Cook et Laverton. Cela permet à MFB et FRV de répondre à leurs obligations de fourniture de services d’urgence aux bases de la Défense utilisant de la mousse anti-incendie ne contenant pas de PFAS. En 2014, tous les appareils de lutte contre l’incendie MFB avaient été convertis pour ne transporter que de la mousse de classe B sans fluor -F3- dans leurs réservoirs de mousse.
Australie du Sud
Une interdiction sur les mousses fluorées est entrée en vigueur en Australie-Sud en janvier 2018, mais les titulaires de licence ont la possibilité de demander une exemption dans certaines circonstances.
Australie occidentale
Des travaux détaillés ont été entrepris pour identifier et gérer les PFAS en décembre 2017 ; mais maintenant suivant le NEMP fédéral.
Tasmanie
TasPorts est un leader dans l’approche de la Tasmanie en matière de gestion des PFAS et a complètement éliminé toutes les mousses contenant des PFAS de l’île.
Aéroports
Depuis 2010, Airservices transporte de la mousse anti-incendie sans PFAS dans tous les aéroports civils où elle opère.
NOUVELLE ZELANDE
La Nouvelle-Zélande a exclu l’utilisation du PFOS et du PFOA dans toute substance solide ou liquide importée ou fabriquée pour être utilisée comme produit chimique de lutte contre les incendies dans la norme de 2006 du Fire Fighting Chemicals Group en vertu de la loi néo-zélandaise de 1996 sur les substances dangereuses et les nouveaux organismes.
La contamination du sol et de l’eau par les mousses anti-incendie a été réexaminée en décembre 2020. L’interdiction totale des PFAS dans les mousses anti-incendie s’appliquera à partir de décembre 2025.
Food Standards Australia & New Zealand (FSANZ) a lancé une surveillance des produits chimiques perfluorés dans les aliments depuis avril 2017, avec des directives sanitaires pour les valeurs de dose d’apport quotidien pour le PFOS, le PFOA et le PFHxS.
CANADA
Le Canada a toujours été à l’avant-garde de la sensibilisation et de la réglementation en ce qui concerne les risques inhérents et potentiels liés au rejet de PFAS dans l’environnement et à l’exposition de la population humaine à la contamination par les PFAS par l’eau potable, les produits agricoles et l’usage domestique.
Le gouvernement du Canada envisage des règles qui traiteraient les PFAS en tant que classe plutôt qu’en tant que substances individuelles ou en groupes plus petits. Aborder les PFAS en tant que classe de produits chimiques réduirait les risques de substitution regrettable, soutiendrait des programmes de recherche et de surveillance plus holistiques et offrirait la possibilité de réduire l’exposition future de l’environnement et des humains aux PFAS. Un avis d’intention concernant la vaste catégorie de PFAS a été publié dans la Gazette du Canada, Partie I : Vol. 155 n°17 – 24 avril 2021.
En réponse à l’engagement décrit dans l’avis d’intention, le gouvernement du Canada a publié un projet de rapport sur l’état des substances per- et polyfluoroalkylées (PFAS) pour consultation publique pendant 60 jours. L’avis connexe a été publié dans la Gazette du Canada, Partie I : Vol. 157, n° 20 – 20 mai 2023.
Actuellement, seul un nombre limité de sous-groupes de PFAS sont soumis à une réglementation au Canada. Le PFOS, le PFOA, les PFCA-LC et leurs dérivés connexes ont été évalués et ajoutés à la liste des substances toxiques en vertu de l’annexe 1 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE).
USA
En 2004, on estimait qu’il y avait environ 45 millions de litres de concentré AFFF aux États-Unis et dans leurs territoires.
La National Defense Authorization Act, adoptée par le Congrès fin 2019, exigeait que la marine américaine publie une nouvelle spécification militaire pour une mousse sans fluor d’ici fin janvier 2023 et exigeait une transition complète vers des mousses anti-incendie sans fluor d’ici octobre 2024. IL avait imposé à la FAA des mandats pour faire passer les aéroports à des mousses sans fluor d’ici octobre 2021, mais cette date limite n’a pas été respectée. Les nouvelles réglementations MIL-SPEC ouvrent la voie à la transition des aéroports et des bases militaires de la FAA, nécessitant des investissements importants. Selon un rapport du Congrès de 2021, les aéroports militaires et civils disposent encore d’environ 50 millions de litres de concentré AFFF dans leurs installations. Bien que l’armée n’ait pas encore officiellement approuvé une mousse sans fluor à utiliser dans ses installations, il existerait désormais un petit nombre de produits disponibles dans le commerce qui ont passé avec succès les tests de performance appropriés tels que UL.
Aux États-Unis, chaque État suit sa propre voie. Le scandale de la non-divulgation d’informations sur la toxicité des produits fluorés et l’impact environnemental, ainsi que d’informations purement erronées, est né d’une longue série de procès contre les fabricants de matières premières PFAS. L’histoire a même culminé avec la publication d’annonces d’avocats à la recherche de clients pour saisir le tribunal !

Les gouvernements des États prennent des mesures législatives et réglementaires pour éliminer progressivement les PFAS des produits afin de prévenir la contamination au profit d’alternatives plus sûres. Par exemple, les lois du ME et de WA ont donné aux agences d’État le pouvoir d’interdire les PFAS dans une large gamme de produits. La loi du Maine oblige les fabricants de produits à divulguer la présence de PFAS. Plusieurs États ont adopté des restrictions sur les PFAS dans les textiles, l’État de Californie interdisant les PFAS dans presque tous les textiles d’ici 2025, et l’État de New York les limitant dans les vêtements, l’État de Washington les interdisant dans les meubles rembourrés et l’État de Washington allant de l’avant avec des mesures réglementaires sur de nombreuses catégories de produits textiles. Six États (CA, CO, ME, MD, NY et VT) ont adopté des restrictions sur les PFAS dans les tapis, les moquettes et les traitements textiles après-vente. Douze États (CA, CO, CT, HI, MD, ME, MN, NY, OR, RI, VT et WA) ont promulgué des interdictions étatiques sur les PFAS dans les emballages alimentaires. Quatre États (CA, CO, MD et WA) ont adopté des restrictions sur les PFAS dans les produits de soins personnels. CO a également adopté des restrictions sur les produits pétroliers et gaziers. Onze États, dont CA, CO, CT, HI, IL, ME, MD, NH, NY, VT et WA, ont mis en place des interdictions sur la vente de mousse anti-incendie contenant des PFAS. Avec la législation adoptée l’année dernière, WA évalue des alternatives plus sûres aux PFAS dans d’autres produits tels que les vêtements, les nettoyants, les revêtements et les finitions de sol, les équipements de pompier et autres, avec un calendrier d’adoption de restrictions d’ici 2025. Source www.saferstates.org
Sous la pression et la menace financière des procès judiciaires, la plupart des fabricants américains ont arrêté la fabrication des émulseurs AFFF et ont lancé la promotion des produits sans fluor, non seulement aux USA, mais aussi auprès de leurs marchés et clients traditionnels à l’international.
Élimination des déchets PFAS
Il s’agit d’un problème énorme et potentiellement extrêmement coûteux. Lors d’incidents majeurs tels que Milford Haven (août 1983), Sandoz Basel (novembre 1986), Coode Island (Melbourne août 1991), Buncefield (décembre 2005) ou Campbellfield (Melbourne avril 2019), des dizaines de millions de litres contaminés par les eaux de ruissellement des eaux d’incendie ont été rejetés dans l’environnement – le confinement total lors d’incidents aussi importants est presque impossible et tous les déchets collectés doivent être éliminés de manière appropriée. Les anciens stocks d’émulseurs fluorés représentent une dépense financière importante dans le cadre de la transition vers des produits sans fluor, tout comme la décontamination des équipements fixes et mobiles.
Actuellement, la méthode la plus efficace, la plus réalisable financièrement et la plus durable sur le plan environnemental pour éliminer de grandes quantités de déchets solides ou liquides contaminés par les PFAS semble être l’incinération à très haute température. Les coûts peuvent varier entre 1 000 et 3 000 USD par tonne, en fonction du niveau accepté de contaminant fluoré résiduel.
CONCLUSION
De plus en plus de réglementations, notamment en Europe et en Australie/Nouvelle-Zélande, ciblent les applications particulièrement dispersives utilisant des PFAS telles que les mousses anti-incendie. La transition des mousses AFFF aux mousses sans fluor -F3- est devenue possible, compte tenu des progrès technologiques rapides au cours des 5 à 10 dernières années et des produits sans fluor capables de rivaliser avec les AFFF sur la base de leurs performances.
De nombreuses grandes organisations telles que les aérodromes civils et militaires, ainsi que les industries pétrolière et gazière, chimique et mécanique telles que Equinor, Bayer, Lufthansa et BMW, sont déjà devenues sans fluor, ayant également résolu les problèmes de décontamination des équipements contaminés par les AFFF. ainsi que la compatibilité en termes de systèmes de livraison et de formation opérationnelle.
Plus récemment, nous avons constaté une certaine prise de conscience au sein des organismes de réglementation de l’environnement – Singapour, Mexique, Colombie – démontrant un profond intérêt pour ce qui se passe dans d’autres pays ; il est probable que l’interdiction des « produits chimiques éternels » soit étendue à la communauté mondiale dans les 5 à 10 prochaines années !
References
Krogerus, M. (2012) The Decision Book: Fifty Models for Strategic Thinking. Tschäppeler, R. and Piening, J. (1st American edition), New York, W.W. Norton & Co., pp. 86-87.
Rumsfeld, D. (2002)
Rio Convention (1992)
United States (1933) Securities Act.
Preston, B.J. (2017) The Judicial Development of the Precautionary Principle. Queensland Government Environmental Management of Firefighting Foam Policy Implementation Seminar 21 February 2017, Brisbane, Qld., pp. 26.
Preston, B.J. (2018) ‘The Judicial Development of the Precautionary Principle’ Environmental and Planning Law Journal 135, 23-42.
Allcorn, M., T. Bluteau, J. Corfield, G. Day, M. Cornelsen, N.J.C. Holmes, R.A. Klein, J.G. McDowall, K.T. Olsen, N. Ramsden, I. Ross, T.H. Schaefer, R. Weber, K. Whitehead. (2018) “Fluorine-Free Firefighting Foams (3F) Viable Alternatives to Fluorinated Aqueous Film-Forming Foams (AFFF).” UN Stockholm Convention POPRC14 Rome 17-21 September 2018, IPEN Gothenburg Sweden: IPEN F3 Expert Panel. < www.ipen.org >
Bluteau, T., M. Cornelsen, G. Day, N.J.C. Holmes, R.A. Klein, J.G. McDowall, K.T. Olsen, M. Tisbury, and L. Ystanes. (2019) “The global pfas problem: fluorine-free alternatives as solutions firefighting foams and other sources-going fluorine-free.” UN Stockhom Convention COP9 Geneva Apr-May 2019, IPEN Gothenburg Sweden: IPEN F3 Expert Panel. < www.ipen.org >
Bluteau, T., M. Cornelsen, N.J.C. Holmes, R.A. Klein, M. Tisbury, and K. Whitehead. (2019) “Perfluorohexane sulfonate (pfhxs)-socio-economic impact, exposure, and the precautionary principle.” UN Stockholm Convention POPRC15 Rome Sep-Oct 2019, IPEN Gothenburg Sweden: IPEN F3 Expert Panel.
< www.ipen.org >
3F AMERICAS A VU LA LUMIERE
3F AMERICAS va démarrer la promotion et la distribution d’un ensemble de nouveaux produits grâce à son réseau de distribution en Amérique Latine. Ces nouveaux produits sont une véritable révolution dans le domaine de la protection individuelle des pompiers.
Un des équipements est un ligne guide lumineuse qui fonctionne dans les 2 sens. La ligne résiste à la chaleur, à l’abrasion et est déclinée en 3 versions : une ligne personnelle de 25 mètres, une ligne portable de 50 mètres, et une ligne waterproof de 25 mètres pour les opérations aquatiques.
L’autre équipement est un avertisseur de détresse personnel. Il offre plusieurs avantages UNIQUES. Il intègre 6 fonctions différentes, et génère une alarme sonore – 98 dB – et visuelle en réagissant aux mouvements, à la température et aux chocs. Il est protégé IP68 et sa batterie fonctionne 20 heures et peut être rechargée directement sur son socle de chargement. C’est le plus léger du marché avec un poids de 120 g. En savoir plus…
Des AFFF aux F3 : Impact — Partie 4
Comme nous l’avons lu précédemment dans les trois premières parties de cette série d’articles, nous avons vu que les produits chimiques perfluorés ont une longue histoire s’étendant sur plus de 50 ans et qu’il est beaucoup plus complexe que de simplement considérer le PFOS, le PFHxS et le PFOA. Au contraire, il y a littéralement des milliers de produits chimiques perfluorés utilisés dans l’industrie et le commerce et se concentrer uniquement sur quelques structures nommées est inutile et une forme de « vision tunnel ».

À l’heure actuelle, des arguments solides ont été avancés pour traiter les PFAS comme une classe de composés chimiques, plutôt que comme des composés individuels nécessitant chacun l’évaluation du risque [Kwiatkowski et al (2020)], afin de contrer les inconvénients de se concentrer sur quelques PFAS particuliers. En cherchant à réglementer l’utilisation des PFAS, le concept ‘’d’applications essentielles » a été proposé par le groupe Cousins [Roy et al. (2022); Figuiére et al. (2023)].
Les intérêts universitaires et réglementaires indépendants pour cette catégorie de composés étaient pratiquement inexistants, à quelques exceptions près, jusqu’à ce que la société 3M annonce en mai 2000 qu’elle éliminait progressivement toute chimie à base de PFOS pour la remplacer par de la chimie à base de PFBS. (acide perfluorobutane sulfonique, l’homologue en C4 du PFOS). Il y eu cependant une exception notable concernant la contamination dans l’environnement, dans les travaux publiés par Jennifer Field et ses collègues de l’Oregon State University à peu près au même moment ou peu après que 3M ait annoncé son retrait de la chimie du PFOS et des émulseurs [Moody et al. (2000); Schultz et al. (2004)].
Les activités d’enquête concernant cette catégorie de composés ont commencé peu après l’annonce de 3M en mai 2000. Au début, la plupart des contributions provenaient de l’industrie elle-même ou de groupes financés par l’industrie. C’est à la fin des années 2000 que la communauté scientifique indépendante s’est rendu compte qu’il fallait faire beaucoup plus d’études sur l’impact des PFAS sur la santé humaine et l’environnement, ainsi que le nombre de publications évaluées par les scientifiques a augmenté de façon exponentielle.
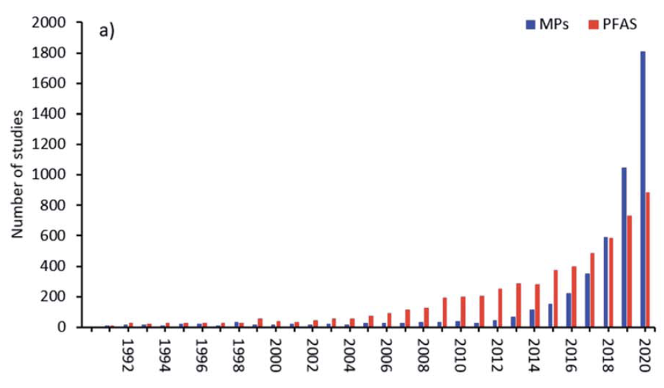
Les publications concernant les PFAS dans la période précédant mai 2000 étaient seulement de l’ordre de 5 à 10 par an. Après mai 2000, ils sont passés à environ 50 par an et ont augmenté de façon exponentielle jusqu’à atteindre maintenant ~1000/an, fréquemment associés à une augmentation parallèle des articles sur les microplastiques [Bakhshoodeh et Santos (2022)], dont la figure 2(b) est tirée.
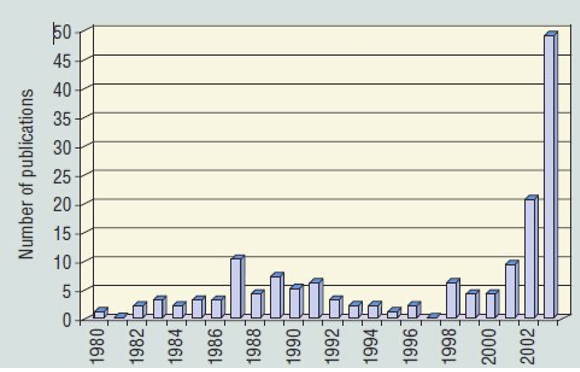
Les études publiées sur l’impact du PFOS et du PFOA dans l’environnement étaient rares avant 2001, jusqu’à ce que Giesy et Kannan [Giesy et Kannan (2001) et les articles subséquents] signalent la présence mondiale du PFOS dans la faune avec Hansen et al. trouvant du PFOS et du PFOA en aval d’une usine de fabrication située dans la rivière Tennessee [Hansen et al. (2002)], ainsi que dans des matrices biologiques en utilisant la spectrométrie de masse [(Hansen et al. (2001)].
La contamination d’échantillons de sang humain par des composés organofluorés – non présents dans le sang entreposé avant le début de la fabrication de produits chimiques fluorés- a été signalée quelques années plus tôt dans les années 1960 [Taves, D.R. (1966, 1968)] avec Guy et al. (1976). La déclaration de la présence de produits chimiques fluorés dans le plasma humain à l’aide de la spectroscopie RMN, a identifié provisoirement le PFOA comme la substance perfluorée (utilisée dans Scotchgard®) comme contaminant sanguin [Guy, W.S. et al. (1976)]. Bien qu’il y ait eu une confusion initiale quant à savoir si cette substance perfluorée était bel et bien du PFOA ou du PFOS, en raison de l’obfuscation et du refus de 3M d’identifier le PFOS, ce n’est que 25 ans plus tard que Hansen et al. (2001) ont signalé que des échantillons de plasma humain contenaient du PFOS. (moyenne de 28,4 ng/ml), PFHxS (moyenne de 6,6 ng/ml) et PFOA (moyenne de 6,4 ng/ml), confirmant les résultats de Guy et Taves.
Une poursuite intentée en 2010 par le procureur général du Minnesota contre la société 3M a révélé que la société savait que ces produits chimiques étaient accumulés dans le sang humain depuis plus de 40 ans et étaient toxiques [Lerner (2018); Swanson (2019)].
Jusqu’en 2004 environ, la littérature scientifique était dominée par des articles d’auteurs travaillant directement pour 3M ou financés par l’industrie. Après 2004, il y a eu une explosion exponentielle du travail publié indépendant concernant le
PFOS, le PFOA et d’autres PFAS, dans la mesure où ces composés organofluorés ont été étiquetés comme des « contaminants émergents ». Les PFAS sont devenus des contaminants préoccupants depuis au moins une décennie. La situation actuelle est que, même si nous en savons maintenant beaucoup sur l’environnement – distribution, devenir et toxicité pour le biote des PFAS-, c’est la technologie de traitement et d’élimination de ces matières hautement persistantes qui devrait être considérée comme une « science émergente ».
Comme indiqué précédemment, nous ne parlons pas seulement de quelques substances, mais d’au moins 6000 composés perfluorés différents qui ont été classés pour au moins un paramètre environnemental, sanitaire et/ou physicochimique dans la base de données de l’ECHA. Lors de la réunion du Comité d’examen des polluants organiques persistants de la Convention de Stockholm des Nations Unies à Rome (POPRC-14), une liste indicative des substances liées au PFOA contenait 4700 produits.
Les paramètres de santé humaine sont considérés comme d’une importance majeure pour l’exposition à long terme : cancérogénicité (C) mutagénicité (Mo); toxicité pour la reproduction (R); effets sur la lactation (L) et toxicité pour certains organes (STOT). 388 PFAS ont au moins un de ces cinq critères, dont 44 sont enregistrés par REACH dans la classification harmonisée CLP.
En ce qui concerne les dangers environnementaux, 1129 PFAS ont été enregistrés par auto-classification; la plupart d’entre eux comptant à la fois (M) mobile et / ou très persistant (vP).
En vertu de la législation communautaire sur les produits chimiques (REACH et ECHA), les risques posés par les PFAS sont classés selon le système PBT indiquant la persistance (P ou vP), la bio-accumulation (B ou vB) et la toxicité (T). Des propositions récentes de l’Agence fédérale allemande pour l’environnement (UBA) soulignent également l’importance de la mobilité (M ou vM), en particulier pour les PFAS, compte tenu de leurs propriétés vP et vM [Arp et al. (2023)]. Les substances chimiques peuvent également être identifiées comme substances très préoccupantes (SVHC) dans le cadre de REACH EC1907/2006 si elles ont des effets graves et souvent irréversibles sur la santé humaine ou l’environnement. Un exemple récent est l’acide perfluorononanoïque ou PFNA, un PFAS en C9 qui est de plus en plus couramment trouvé comme contaminant. En Europe, les composants individuels de la classification du PBT ont suscité beaucoup plus de préoccupations, tandis qu’aux États-Unis, la persistance à elle seule avec la toxicité qui l’accompagne est considérée comme moins problématique.
Persistance
Les PFAS ou leurs produits de dégradation perfluorés comptent parmi les composés organiques les plus stables sur le plan chimique et physique. Leurs chaînes de carbone perfluorées résistent à la dégradation environnementale et métabolique due aux liaisons C-F très stables. Par exemple, le tétrafluorométhane CF4 , un perfluorocarbone simple, a une demi-vie atmosphérique estimée d’environ 50000 ans avec un potentiel de réchauffement planétaire (GW) élevé [Mühle et al., 2010].
Les composés perfluorés disponibles dans le commerce sont conçus pour se dégrader rapidement une fois rejetés dans l’environnement et produisant des PFCA, des PFECA et des PFSA. Malheureusement, cela a mené dans le passé à des affirmations totalement fausses et trompeuses faites par l’industrie, en particulier aux États-Unis, selon lesquelles ces matériaux sont « biodégradables » en raison de la dégradation du groupe fonctionnel non fluoré et la règle de l’OCDE selon laquelle une substance est « facilement biodégradable » si la dégradation atteint 60 % (OCDE 301B, D et F) ou 70 % (OECD301A et E) dans les 28 jours. Cela ne signifie pas que le PFAS, utilisé par exemple dans la lutte contre l’incendie AFFF, est complètement biodégradable car la méthode COD utilisant du dichromate acide pour la mesure de l’oxydation pour donner le niveau de 100% ne tient pas compte totalement de toute matière perfluorée présente. Malheureusement, les utilisateurs finaux ont souvent supposé ou été amenés à croire par les vendeurs, et perpétrés comme un mythe par certains fabricants [Swanson, 2019], que « facilement biodégradable » signifie dégradation totale. Comme nous l’avons déjà souligné, il est toutefois logique de regrouper tous les PFAS comme étant non dégradables en fonction de leurs produits finaux de dégradation stables.
La dégradation des précurseurs entraîne souvent la formation d’intermédiaires de PFAS et de produits de dégradation ultimes avec une mobilité accrue dans l’eau et/ou l’air par des processus de dégradation chimique et biochimique oxydative dans l’environnement.
`
La durée de vie des PFAS dans l’environnement dépasse largement les critères pour les substances très persistantes (vP) de l’annexe XIII de REACH. Si les PFAS se dégradent, ils le font si lentement qu’il n’est pas observable dans les tests standard. La persistance extrême des PFAS et leur utilisation continue entraînent une exposition soutenue et des concentrations croissantes dans tous les compartiments de l’environnement. Les PFAS resteront dans l’environnement pendant très longtemps, même si les rejets sont réduits au minimum. Une contamination croissante ou héritée de l’environnement augmentera la probabilité que des effets connus et inconnus se produisent sur une échelle de temps générationnelle. Cela devrait suffire à invoquer l’application du principe de précaution [Rio 1992; Preston, 2017] à toute autre utilisation dispersive des PFAS.
Les scientifiques ont souligné dans la Déclaration d’Helsingør sur les PFAS [Scheringer et al., 2014] ainsi que dans la déclaration de Madrid [Blum et al., 2015] que la persistance très élevée en soi pose un problème et ont nommé cette approche « P-suffisante » pour les mesures réglementaires. La persistance à elle seule a justifié la réglementation des PFAS en tant que classe en Californie [Balan et al., 2021].
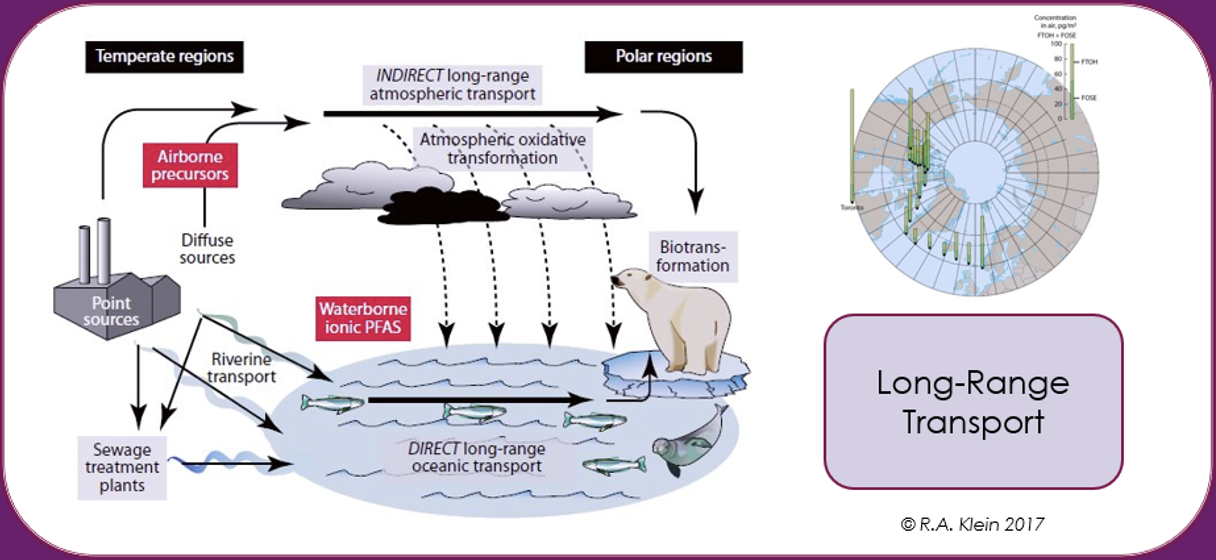
Potentiel de transport à longue distance (LRTP)
Les PFAS peuvent être transportées par l’air, l’eau et les matrices auxquelles elles sont adsorbées ou absorbées, comme la poussière, les sédiments, les aérosols marins, les courants océaniques, les animaux atmosphériques et migrateurs, ou par des matrices dans lesquelles elles sont incluses comme additifs, comme les microplastiques. En raison de leur résistance remarquable à la dégradation, cela conduit à une dispersion globale des PFAS sur de longues distances à partir du point de libération. Il a été estimé, par exemple, que pour les PFAS volatiles tels que les alcools fluorotélomères dans la haute atmosphère, les temps de circulation globale peuvent être courts de 7 à 10 jours. La propagation historique des PFAS par le biais de la LRTP par le dépôt et la contamination dans l’Arctique est bien documentée [Wilson et al. (AMAP) Secretariat, 2017].
La population inuite de l’Arctique a été signalée comme étant parmi les humains les plus contaminés de la planète, car les concentrations de SPFA dans le sang sont beaucoup plus élevées que la valeur moyenne de la population générale. Étant à ce jour éloignée de toute source industrielle de PFAS, cette contamination a été attribuée principalement à leur alimentation, basée sur le poisson, l’ours blanc et la viande de phoque, avec un impact sur la réponse immunitaire [Sonne et al., 2023].
Ainsi, la contamination de l’environnement et du biote par les PFAS ne se limite pas géographiquement à la source de la pollution, mais se généralise à l’échelle mondiale en raison de l’utilisation dispersive, comme dans les mousses anti-incendie, les mauvaises techniques d’élimination des déchets ou la production industrielle, Elle est aggravée par le transport à grande distance dans l’atmosphère et les océans.
Mobilité
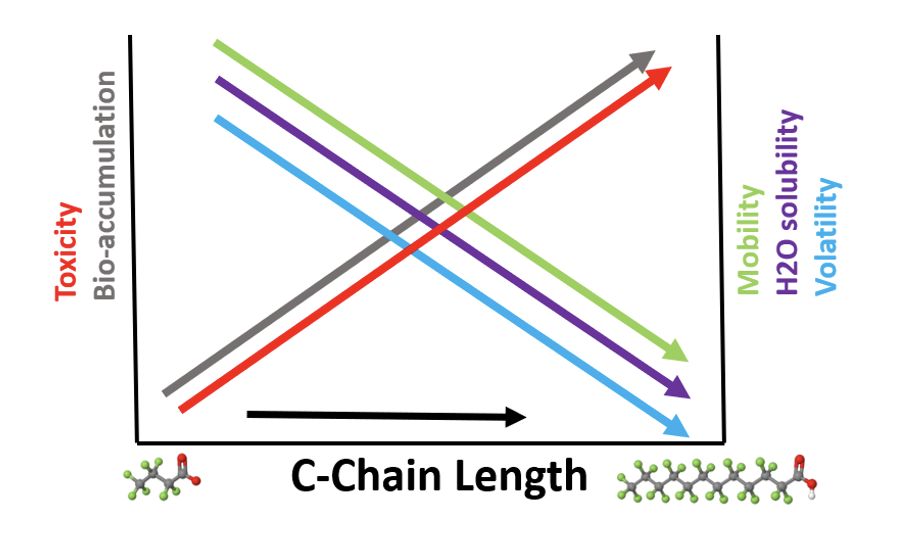
On considère généralement que les substances ayant une solubilité modérée à élevée dans l’eau et un faible potentiel d’adsorption ont une mobilité élevée dans l’environnement aqueux. Diverses études ont montré que les PFAS ont un comportement différent en fonction de la longueur de la chaîne de carbone et de la fonctionnalité.
Comme le montre la figure ci-dessous, les PFAS de longueur de chaîne plus courte sont associées à une mobilité environnementale, à une solubilité dans l’eau et à une volatilité plus élevées, ainsi qu’à un potentiel de toxicité et de bioaccumulation plus faible que les SPFA de longueur de chaîne plus longue. La combinaison d’une persistance extrême et d’une grande mobilité dans le milieu aqueux et les sols, en particulier pour les PFAS à chaîne courte comme le PFOS et ses produits apparentés, entraîne la contamination des aquifères et des rivières de l’eau potable ainsi que l’absorption dans la chaîne alimentaire – poissons, plantes et bétail.
Accumulation dans les plantes
Un article de synthèse récent sur les voies d’exposition, la bioaccumulation et les effets toxiques des PFAS sur les plantes montre que les processus de bioaccumulation des PFAS chez les plantes varient grandement en raison de la complexité de la chimie des PFAS [Li et coll., 2022].
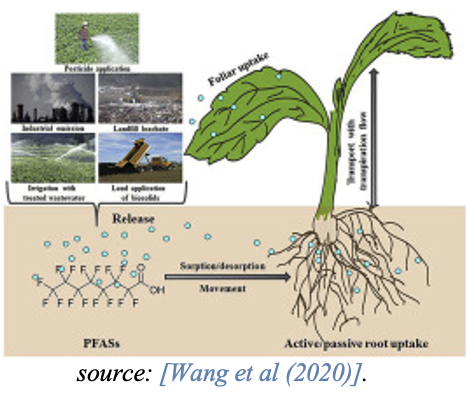
Alors que les PFAS à chaîne courte s’accumulent généralement dans les parties aériennes de la plante telles que les feuilles, les PFAS à chaîne longue s’accumulent dans les racines et présentent des facteurs de translocation plus faibles vers les parties aériennes de la plante. Ceci est influencé par la plus grande solubilité dans l’eau, la taille moléculaire inférieure et l’hydrophobicité inférieure des PFAS à chaîne courte. Des études indiquent également que les PFCA à chaîne courte sont plus efficacement absorbés par les plantes que les PFCA à chaîne longue [Felizeter et coll., 2014; Yoo et coll., 2011].
La consommation de matières végétales, p. ex., les céréales et les légumes sous forme de racines ou de parties de plantes hors sol comme les feuilles ou les tiges, constitue une source de PFAS pour les humains et les animaux.
Bio-accumulation et Bio-magnification (magnification tropique)
Dans le cadre de REACH, il a été démontré que les PFCA en C11-C14 et les PFCA en C6 satisfont au critère vB et les PFCA en C8-C10 au critère B.
Des études menées auprès d’espèces de mammifères montrent que les PFAS sont facilement absorbés et distribués dans divers tissus et que certaines PFAS (en particulier les PFAS à longue chaîne) ont une longue demi-vie dans les organismes, en particulier chez les humains où les demi-vies sont de l’ordre de plusieurs années. Des études montrent que les PFAS qui se lient à l’albumine et aux protéines de transport distribuent efficacement les PFAS dans différents tissus et améliorent le passage à travers les barrières cérébrales et placentaires, avec transfert aux nouveau-nés via le lait maternel. En raison de leurs propriétés hydrophobes et oléophobes, les PFAS ne suivent pas les schémas d’accumulation typiques, comme le partitionnement dans le tissu adipeux, mais se lient et s’accumulent plutôt dans les organes riches en protéines comme le foie.
Les PFAS s’accumulent davantage dans les êtres vivants qui respirent l’air que dans ceux qui respirent par des branchies, car, contrairement à ces derniers, les êtres pulmonés ne peuvent pas facilement éliminer les PFAS par diffusion passive. Ainsi, les méthodes établies d’essai de bioaccumulation dans les organismes aquatiques ne fonctionnent pas de façon adéquate comme méthodologie pour l’évaluation de la bioaccumulation des PFAS chez les espèces qui respirent l’air, comme l’homme.
Les acides gras perfluoroalkyles à chaîne courte sont plus facilement excrétés par l’excrétion urinaire dans les organismes respirant l’air et ont tendance à être moins bioaccumulables, tandis que le potentiel de bioaccumulation augmente habituellement avec la longueur de la chaîne perfluoroalkyle. En général, les FBC et les FBA des PFAS contenant 8 carbones ou plus augmentent de façon uniforme avec l’augmentation du nombre de carbones dans la chaîne alkyle, le potentiel de bioaccumulation le plus élevé étant observé pour les composés dont la chaîne du carbone est de 12 à 14.
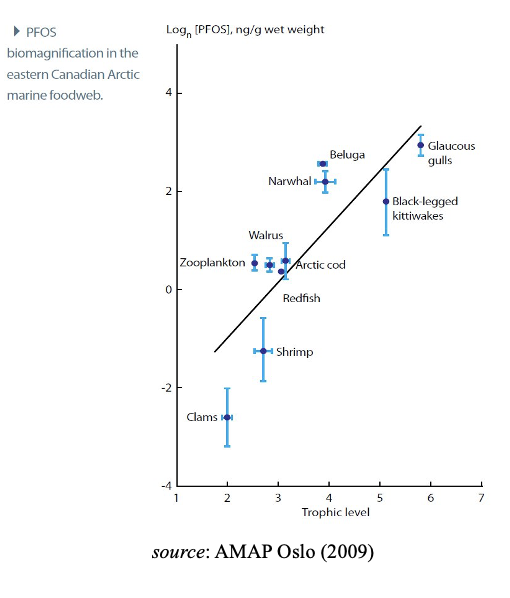
En raison de ces propriétés, de nombreux PFAS s’accumulent dans les êtres respirateurs, et les PFAS à longue chaîne se bio amplifient dans les réseaux trophiques marins et d’eau douce, atteignant des niveaux élevés chez les principaux prédateurs, y compris les humains et les espèces vulnérables. Cette augmentation de la contamination observée lors de l’ascension de la chaîne alimentaire est connue sous le nom de magnification trophique et est bien établie pour les espèces aquatiques et les prédateurs qui s’en nourrissent. Il convient de noter que, par conséquent, cela peut avoir une incidence négative sur les recommandations relatives à la consommation de viande et/ou d’entrailles de certains animaux. Les œufs de guillemot sont particulièrement riches en PFAS.
Des études sur le terrain portant sur des PFAS à chaîne longue et à chaîne courte qui peuvent être distinguées analytiquement démontrent que les PFAS (principalement les PFBA, les PFBS, les PFHpA, les PFHxA, les PFHxS, les PFOS, les 6:2 FTOH, les F-53B, les 6:2 Cl-PFESA, les TFA et les PFCAs en C9-C11) se trouvent globalement dans l’environnement des mammifères. oiseaux, poissons et autres vertébrés. En conclusion, et compte tenu de l’augmentation des éléments de preuve provenant des études de modélisation, de laboratoire et de surveillance, il y a un niveau de préoccupation croissant justifiable pour un sous-ensemble de PFAS étant bio-accumulables. La plupart des composés présentent encore de grandes incertitudes en raison du manque de données.
Effets sur la santé humaine
Un grand nombre de publications ont été publiées sur les effets du PFAS sur la santé, en particulier pour le PFOA et le PFOS. Chez les humains, de nombreux acides perfluoroalkyles (PFAA) sont facilement absorbés par inhalation ou ingestion par voie orale, alors qu’on en sait moins sur l’absorption après une exposition cutanée. Beaucoup de PFAA se lient aux protéines et sont ainsi distribués aux tissus riches en protéines comprenant le foie, les reins, et le sang. Les demi-vies estimées d’élimination humaine pour les PFAS varient de quelques jours (PFCA) et de quelques mois (PFHxA, PFBS) à quelques années (2-8) (PFOA, PFNA, PFDA, PFHxS, PFOS) ou de plus de 10 ans pour les PFCA. Les demi-vies sont beaucoup plus courtes chez les rongeurs que chez les humains et des différences de demi-vie entre les sexes sont souvent observées. Par conséquent, la toxicité observée chez les rongeurs sous-estime la toxicité pour les humains. Les PFAA sont principalement excrétés par l’urine et les fèces et sont donc libérés dans l’environnement. Les PFAA ont un fort potentiel de bioaccumulation chez l’homme, comme le montrent les longues demi-vies et la liaison aux protéines.
L’Agence européenne des normes alimentaires (EFSA) a examiné en profondeur les preuves épidémiologiques d’association entre l’exposition aux PFAS et les effets nocifs chez l’homme [EFSA, 2018; EFSA, 2020]. L’EFSA a conclu que l’augmentation des taux sériques de divers PFCA et PFSA a provoqué une réduction de la réponse immunitaire à la vaccination [Grandjean, 2012], une propension accrue aux infections, une augmentation du cholestérol sérique, une augmentation de l’alanine transférase sérique (ALT) et une réduction du poids à la naissance. L’association avec les effets immunitaires a été considérée comme le paramètre le plus sensible chez l’homme (étayé par des données provenant d’animaux de laboratoire) et l’EFSA a établi une dose hebdomadaire tolérable (DHT) de 4,4 ng/kg de poids corporel/semaine pour la somme des PFOS, PFOA, PFNA et PFHxS. [EFSA, 2020].
Des études menées sur des animaux de laboratoire dans différents groupes de PFAS démontrent que le foie, les reins, la thyroïde, le système immunitaire et la reproduction sont des cibles importantes de la toxicité des PFAS. Dans les études sur le rat, les effets les plus constants comprenaient une hypertrophie du foie, une hypertrophie hépatocellulaire, une augmentation de l’ALT sérique, une augmentation du poids des reins, une reprotoxicité, des effets sur le système lymphatique et une diminution des taux d’hormones thyroïdiennes sériques. En particulier, des effets sur le foie ont été observés pour la plupart des PFAA pour lesquels des études animales sont disponibles. Pour le PFOS, le PFOA, le PFNA et le PFDA et leurs sels, cela a donné lieu à des classifications harmonisées – CLP- pour la cancérogénicité (Carc. 2), la toxicité pour la reproduction (Repr. 1B), les effets sur la lactation (Lact.) et la toxicité pour des organes cibles spécifiques – exposition répétée (STOT RE 1, sauf pour le PFOA).
Effets cumulatifs des PFAS concomitantes
De nombreux PFAS différents coexistent dans l’environnement, l’eau potable, la nourriture et le sang humain. Ils présentent très souvent des effets similaires, principalement sur le foie, les reins, la thyroïde, les lipides sériques et le système immunitaire. Par conséquent, une évaluation des dangers et des risques tenant compte de cette exposition combinée refléterait les conditions d’exposition de façon plus réaliste que les évaluations d’un seul composé.
En raison de l’immense nombre de PFAS et du manque de données toxicologiques pour la grande majorité d’entre elles, une évaluation combinée de toutes les PFAS est impossible. Il est souligné à ce stade que l’exposition combinée à différents PFAS affectant les mêmes organes cibles peut entraîner une combinaison plus importante que les effets additifs, c.-à-d., synergisme, rendant le dépassement des seuils ou des valeurs limites plus probable que pour l’évaluation des substances individuelles.
CONCLUSION
Les PFAS sont très persistants (vP) et beaucoup sont également très bioaccumulables (vB). Les processus de transport à longue distance (LRTP) entraînent une contamination planétaire, y compris dans les régions éloignées comme l’Arctique.
Cousins et al. ont récemment introduit le concept d’avoir déjà dépassé la « limite planétaire », ce qui indique que les concentrations environnementales mondiales de PFAS dépassent déjà les niveaux acceptables durables [Cousins et al., 2022]. Cela devrait être considéré comme un avertissement contre l’utilisation continue et le rejet de PFAS dans l’environnement, en particulier à partir d’applications dispersives telles que la mousse anti-incendie AFFF.
La présence permanente de PFAS dans le sang humain indique le niveau d’exposition continue de la population générale. Les PFAS sont présents dans l’eau potable et dans les stocks alimentaires. Des centaines d’études scientifiques ont mis en évidence la toxicité à long terme des PFAS, affectant le foie, les reins, la thyroïde et le système immunitaire. La présence omniprésente de PFAS dans le sang humain et de nombreuses espèces dans le monde met en évidence les dangers associés à la fabrication et à l’utilisation continues dans les produits industriels et de consommation de polluants organiques extrêmement persistants d’origine totalement anthropique, non naturels.
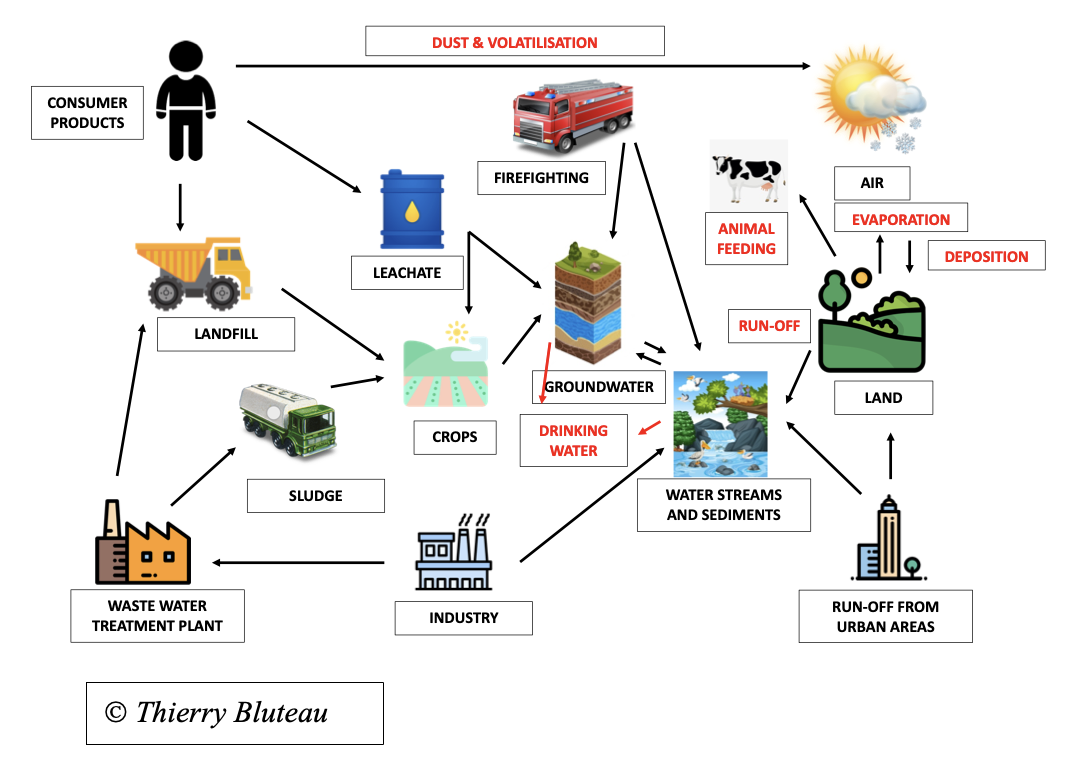
Ce schéma résume toutes les possibilités pour les PFAS de contaminer l’environnement et les êtres vivants, y compris les humains.
Références bibliographiques
Arp, H.P.M., Hale, S.E., Borchers, U., Valkov, V., Wiegand, L., Zahn, D., Neuwald, I., Nödler, K., and Scheurer, M. (2023) A prioritization framework for PMT/vPvM Substances under REACH for registrants, regulators, researchers and the water sector. German Environment Agency (Umweltbundesamt) Report 22/2023 pp. 1-238.
Bakhshoodeh, R., and Santos, R.M. (2022) Comparative bibliometric trends of microplastics and perfluoroalkyl and polyfluoroalkyl substances: how these hot environmental remediation research topics developed over time. RSC Advances 12, 4973-4987.
Bălan, .A., ChanderMathrani, V., Fengmao Guo, D., and Algazi1, A.M. (2021) Regulating PFAS as a Chemical Class under the California Safer Consumer Products Program. Environ. Health Perspect, 129 (20) February 025001, 1-9.
Blum, A., Balan, S.A., Scheringer, M., Trier, X., Goldenman, G., Cousins, I.T., Diamond, M., Fletcher, T., Higgins, C.P., Lindeman, A.E., Peaslee, G., de Voogt, P., Wang, Z., and Weber, R. (2015) The Madrid Statement on Poly- and Perfluoroalkyl Substances (PFASs). Environ. Health Perspect. 123 (5) May A107-A11.
Cousins, I.T., Johansson, J.H., Salter, M.E., Sha, B. and Scheringer, M. (2022) Outside the Safe Operating Space of a New Planetary Boundary for Per- and Polyfluoroalkyl Substances (PFAS). Environ. Sci. Technol. 2022, 56, 11172−11179.
European Food Standards Agency (EFSA) (2018) Risk to human health related to the presence of perfluorooctane sulfonic acid and perfluorooctanoic acid in food. EFSA Journal 16(12), 5194.
European Food Standards Agency (EFSA) (2020) Risk to human health related to the presence of perfluoroalkyl substances in food. EFSA Journal 18(9), 6223.
Felizeter, S., McLachlan, M.S., and de Voogt, P. (2014) Root uptake and translocation of perfluorinated alkyl acids by three hydroponically grown crops. J. Agric. Food Chem. 62 (15), 3334-42.
Figuiére, R., Borchert, F., Cousins, I.T., and Ågerstrand, M. (2023) The essential-use concept: a valuable tool to guide decision-making on applications for authorization under REACH? Environmental Sciences Europe 35 (5) 1-12.
Giesy, J.P., and Kannan, K. (2001) Global Distribution of Perfluorooctane Sulfonate in Wildlife. Environ. Sci. Technol. 35(7) 1339-1342.
Grandjean, P., Andersen, E.W., Budtz-Jørgensen, E., Nielsen, F., Mølbak, K., Weihe, P., and Heilmann, C. (2012) Serum vaccine antibody concentrations in children exposed to perfluorinated compounds. JAMA 307(4), 391-7.
Guy, W.S., Taves, D.R., Brey, W.S. (1976) Fluorocompounds in Human Plasma: Prevalence and Characterization. Biochemistry Involving Carbon-Fluorine Bonds, ACS Symposium. 117-134
Hansen, K.J., Clemen, L.A., Eellefson, M.E., and Johnson, H.O. (2001) Compound-specific quantitative characterization of organic fluorochemicals in biological matrices. Environ. Sci. Technol. 35(4) 766-770.
Hansen K.J., Johnson, H.O., Eldridge, J.S., Butenhoff, J.L., and Dick, L.A. (2002) Quantitative Characterization of Trace Levels of PFOS and PFOA in the Tennessee River. Environ. Sci. Technol. 36(8) 1681-1685.
Kwiatkowski, C.F., Andrews, D.Q., Birnbaum, L.S., Bruton, T.A., DeWitt, J.C., Knappe, D.R.U., Maffini, M.V., Miller, M.F., Pelch, K.E., Reade,A., Soehl, A., Trier, X., Venier, M., Wagner, C.C., Wang, Z., and Blum, A. (2020) Scientific Basis for Managing PFAS as a Chemical Class. Environ. Sci. Technol., 7, 532−543.
Lerner, S. (2018)] 3M knew about the Dangers of PFOS and PFOA Decades Ago, Internal Documents Show. The Intercept July 18 2018.
Li, J., Sun, J., and Li, P. (2022) Exposure routes, bioaccumulation and toxic effects of per- and polyfluoroalkyl substances (PFASs) on plants: A critical review,. Environ. International 158, 106891.
Moody, C.A., and Field, J.A. (2000) Perfluorinated Surfactants and the Environmental Implications of Their Use in Fire-Fighting Foams. Environ, Sci. Technol. 34(18), 3864-3869.
Mühle, J., Ganesan, A.L. , Miller, B.R, Salameh, P.K., Harth, C.M., Greally, B.R.,, Rigby, M., Porter, L.W., Steele, L.P., Trudinger, C.M.,, Krummel, P.B., O’Doherty, S.,, Fraser, P.J., Simmonds, P.G., Prinn, R.G.,, and Weiss, R.F.. (2010) Perfluorocarbons in the global atmosphere: tetra-fluoromethane, hexafluoroethane, and octafluoropropane. Atmos. Chem. Phys. 10, 5145–5164.
Preston, B.A. (2017) The Judicial Development of the Precautionary Principle. Queenslnad Government Environmental Management of Firefighting Foam Policy Implementation Seminar, Brisbane 21 Febraury 2017. pp. pp.1`-26. < https://lec.nsw.gov.au >.
Rio Convention (1992) UN Conference on Environment and Development, Rio de Janiero, Brazil, 3-14 June 1992.
Roy, M.A., Cousins, I.T., Harriman, H., Scheringer, M., Tickner. J.A., and Wang, Z. (2022) Combined Application of the Essential-Use and Functional Substitution Concepts: Accelerating Safer Alternatives Environ. Sci. Technol. 56, 9842−9846.
Scheringer, M., Trier, X., Cousins, I.T., de Voogt, P., Fletcher, T., Wang, Z., and Webster, T.F. (2014) Helsingør Statement on poly- and perfluorinated alkyl substances (PFASs). Chemosphere 114 (2014) 337–339.
Schultz, M.M., Barofsky, D.F., and Field, J.A. (2004) Quantitative Determination of Fluorotelomer Sulfonates in Groundwater by LC MS/MS. Environ. Sci. Technol. 38 (6) 1828-1835.
Sonne, C., Desforges, J.-P., Bossi, R., and Long, M. (2023) Assessment of Exposure to Perfluorinated Industrial Substances and Risk of Immune Suppression in Greenland and its Global Context: a Mixed-Methods Study. Lancet Planetary Health 7 (7), E570-E579, July 2023.
Swanson, L. (2019) Testimony of Lori Swanson Former Minnesota Attorney General before the Committee on Oversight and Reform Subcommittee on Environment United States House of Representatives. September 10, 2019. pp. 1-66.
Taves, D.R. (1966) Normal human serum fluoride concentrations. Nature 211, 192-193.
Taves, D.R. (1968) Evidence that there are Two Forms of Fluoride in Human Serum. Nature 217, 1050-1051.
Wang, W., Rhodes, G., YU, X., and Li, H. (2020) Uptake and accumulation of per- and polyfluoroalkyl substances in plants. Chemosphere 261, 127584.
Wilson, S., Fuglestad, J., Larsen, J.-R., Pawlak, J., and Utne, I. (2017) (AMAP Secretariat). Chemicals of Emerging Arctic Concern. Arctic Monitoring and Assessment Programme (AMAP), Oslo, Norway. xvi+353pp.
Yoo, H., Washington, J.W., Jenkins, T.M., and Ellington, J.J. (2011) Quantitative determination of perfluorochemicals and fluorotelomer alcohols in plants from biosolid-amended fields using LC/MS/MS and GC/MS. Environ. Sci. Technol. 45(19), 7985-90.
EXPO FIRE – Mexico City
Notre société sœur 3F MEXICO a participé au salon professionnel EXPO FIRE qui s’est tenu à Mexico City les 27 et 28 Aout 2024.
Le salon a été particulièrement animé et nos commerciaux ont eu l’opportunité de présenter notre catalogue de produits à plus de 250 sociétés. Certains produits phares, tels que les émulseurs FREEGFEN sans fluor, les mannequins RUTH LEE et encore les systèmes d’extinction automatiques KIZENITH pour feux de cuisine, ont largement retenu l’attention.


Des AFFF aux F3 : Fluorotélomères — Partie 3
Dans la partie 2 de cette série d’articles, nous avons traité des mousses de classe A et de la chimie des anciens produits AFFF de classe B fabriqués à l’aide du procédé Simons de fluoration électrochimique (ECF). Dans cette partie, les formulations AFFF actuelles utilisant des fluorotélomères sont discutées, fabriquées par des sociétés comme DuPont, Dynax, Ciba Geigy, Elf Atochem, Daikin, Asahi Glass, Clariant, etc.
Fluoro-télomérisation :
En contraste avec le procédé Simons ECF qui produit un mélange d’isomères ramifiés et linéaires avec une longueur de chaîne impaire et uniforme, la fluoro-télomérisation produit des chaînes de carbone paires presque exclusivement linéaires (Vyas et al. 2007 [3], déterminé par le télogène de départ, c.-à-d. l’iodure de perfluoroéthyle (C2F5I) ou l’iodure de perfluorobutyle (C4F9I), qui contient des chaînes de carbone N, N+2, N+4, N+6, etc.
La télomérisation implique l’ajout de radicaux libres de tétrafluoroéthylène (CF2 = CF2), le taxogène, à un iodure d’alkyle, le télogène, tel qu’un iodure de perfluorobutyle (C4F9I) comme indiqué ci-dessous. La chaîne perfluorée est ensuite terminée avec un groupe de diméthylène, -CH2-CH2-, caractéristique des fluorotélomères du produit final.
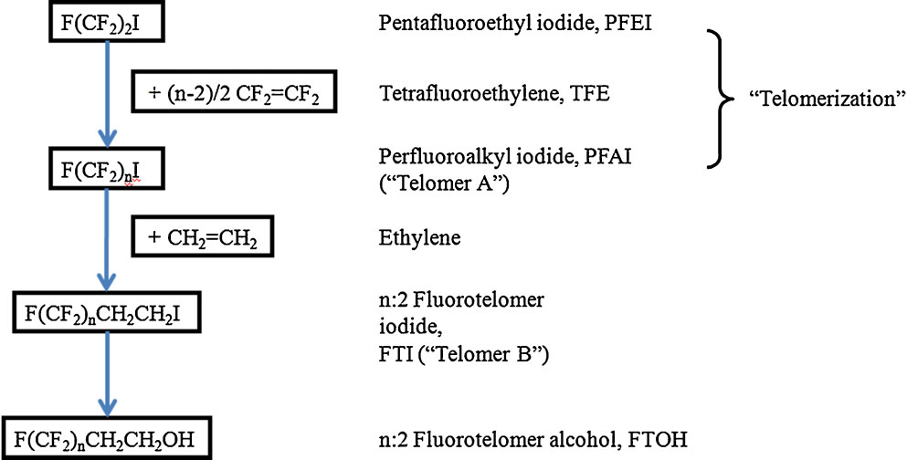
Source : Buck et coll. (2011)
Le produit de départ est l’iodure de perfluoroalkyle, tandis que l’iodure fluorotélomère du produit final réactif est utilisé pour fabriquer une gamme de produits finaux, par exemple des alcools fluorotélomères, des thiols, des acides sulfoniques et des sulfamides.
Il est important de connaître la distribution de la longueur de la chaîne synthétisée pendant la télomérisation pour produire l’iodure de télomère fluoré. La télomérisation produit une série homologue de produits avec des longueurs de chaîne consistant en unités de perfluorocarbones espacées uniformément, par exemple, 4:2, 6:2, 8:2, 10;2, 12:2, 14:2, etc. (N:2 indique N carbones perfluorés attachés à une unité méthylène de deux carbones non fluorés -(CH2)2-. Celle-ci est ensuite purifiée par distillation fractionnée donnant une fraction contenant les longueurs de chaîne plus courtes, c’est-à-dire C4-C10 principalement composée de C6/C8, qui est utilisée principalement pour produire les émulseurs AFFF, et des longueurs de chaîne plus longues >C8 utilisées pour les traitements de tissu, textile, cuir et papier. D’autres variantes structurelles sur le processus de télomère ont été utilisées occasionnellement par certains fabricants, y compris l’utilisation d’un espaceur à trois carbones, -(CH2)3-, au lieu d’une unité à deux carbones.
Après le Programme Stewardship du PFOA lancé en 2010-2015, l’industrie chimique du fluor a déployé des efforts considérables pour réduire la teneur en fluorotélomères 8:2 du précurseur utilisé pour les mousses extinctrices à moins de 25 ppb, car cela peut agir comme précurseur du PFOA après sa dégradation. Les premiers produits utilisés pour fabriquer les tensioactifs fluorés pour la formulation des mousses anti-incendie étaient en fait un mélange de chaînes perfluorées C6/C8 principalement, c’est-à-dire 6:2 et 8:2. Les mousses de télomères fluorés modernes actuelles sont maintenant principalement des mousses 6 :2 et 4:2, et sont appelées par l’industrie ‘’C6 pur’’.
Malheureusement, mais comme on pouvait s’y attendre, le remplacement des formulations de C6/C8 par des télomères fluorés de C6 ‘’purs’’ a entraîné une perte de performance de la mousse, ce qui a exigé l’utilisation de concentrations plus élevées de tensioactifs fluorés, ce qui n’était pas souhaitable du point de vue environnemental.
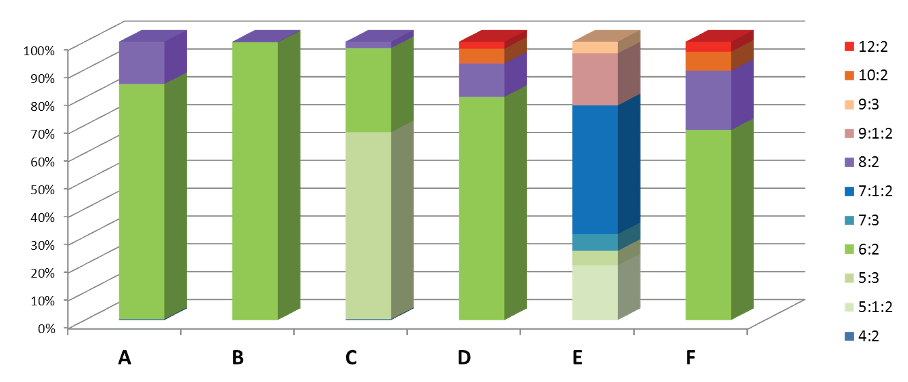
Compositions de six émulseurs ~2005-2010. Data de Backe, Day & Field 2013
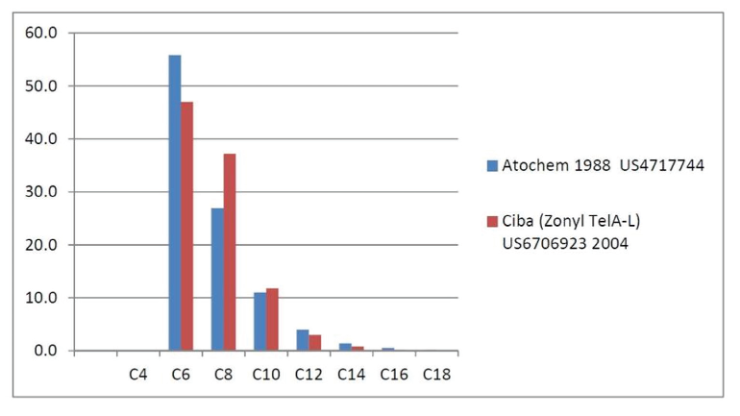
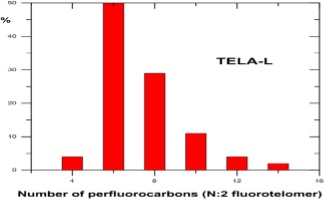
Distribution des homologues intermédiaires de fluorotélomères
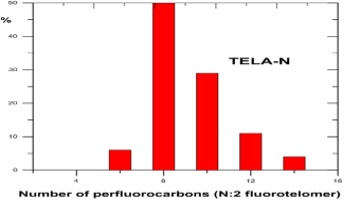
Les composés perfluorés sont utilisés dans les mousses anti-incendie pour réduire la tension superficielle, ce qui permet la formation de pellicule aqueuse sur de nombreux combustibles hydrocarbures, sauf ceux plus courts que l’isooctane, comme l’hexane ou le pentane; pour offrir une excellente résistance à la chaleur et aux produits chimiques; augmenter la répulsion des hydrocarbures et ainsi résister à la contamination par les solvants ou au « mixage avec le carburant »; éliminer efficacement les vapeurs.
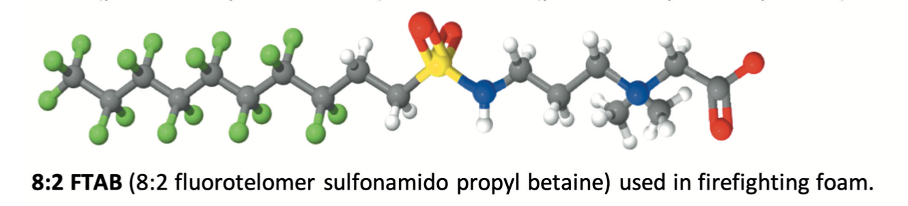
Les fabricants offrent une gamme de produits chimiques perfluorés, dont la plupart sont des tensioactifs fluorés. Ces tensioactifs sont une combinaison d’une queue perfluorée hydrophobe et oléophobe et d’un groupe de tête polaire donnant une fonctionnalité, permettant la dispersion ou la solubilisation des produits dans l’émulseur. L’un des produits les plus populaires et les plus efficaces a été probablement le tensioactif de type bétaïne perfluorée C8:2 et son homologue C6:2.
Mousses sans fluor (F3) de classe B pour hydrocarbures liquides et solvants polaires
Le développement de mousses sans fluor -F3- a commencé à la fin des années 1990 par Ted Schaefer travaillant pour 3M Australie. Au début des années 2000, la première mousse anti-incendie opérationnelle sans fluor, appelée RF-3 et RF-6 pour le produit Rehealing 3% et 6% est devenue disponible. Les pompiers du Queensland sont passés au F3 sans fluor dès 2003. Au cours de la dernière décennie, la technologie de la mousse sans fluor s’est considérablement améliorée au point qu’aujourd’hui, de nombreux produits F3 sont disponibles sur le marché, atteignant voire dépassant dans certains cas les performances des AFFF, tout en offrant un meilleur rapport qualité-prix. Parmi les premiers développements, Solberg Scandinavian a acheté les brevets RF de 3M ainsi que l’expertise de Ted Schaefer en 2007 ; par ailleurs Thierry Bluteau a développé un nouvel F3 dès 2002, travaillant alors pour Bio-Ex France. À la fin des années 2000, Gary McDowall -3F Ltd, UK- a également développé des produits F3. Quelques années plus tard, de nouveaux F3 sont apparus sans solvant, c’est-à-dire sans glycol, réduisant ainsi considérablement le problème de la DBO-DCO, d’environ 40 à 60%. D’autres fabricants ont suivi et aujourd’hui les mousses anti-incendie F3 sont largement disponibles sur le marché, déjà présents dans dans l’aviation civile et militaire, le pétrole et le gaz et les industries pétrochimiques, ainsi que les grands services d’incendie municipaux qui passent des mousses AFFF contenant du fluor aux mousses F3 sans fluor.
La transition a pris près de 10-15 ans, principalement en raison du conservatisme intégré dans de nombreux services d’incendie, mais aussi en raison des coûts impliqués qui comprennent la modification ou le nettoyage de l’équipement existant, ainsi que l’élimination appropriée et coûteuse des stocks existants d’AFFF. Une autre force motrice, en particulier aux États-Unis, a été l’exposition financière et juridique croissante de continuer à utiliser des produits qui entraînent une contamination environnementale persistante et généralisée.
La destruction écologiquement acceptable des stocks AFFF existants, impliquant souvent d’énormes volumes de concentré allant jusqu’à des millions de litres, nécessite des méthodes de destruction très efficaces (> 99,999% DRE), capables de traiter des charges solides et liquides, qui ne contaminent pas davantage l’environnement et qui soient financièrement faisables. Les méthodes actuellement disponibles seront discutées dans un autre article.
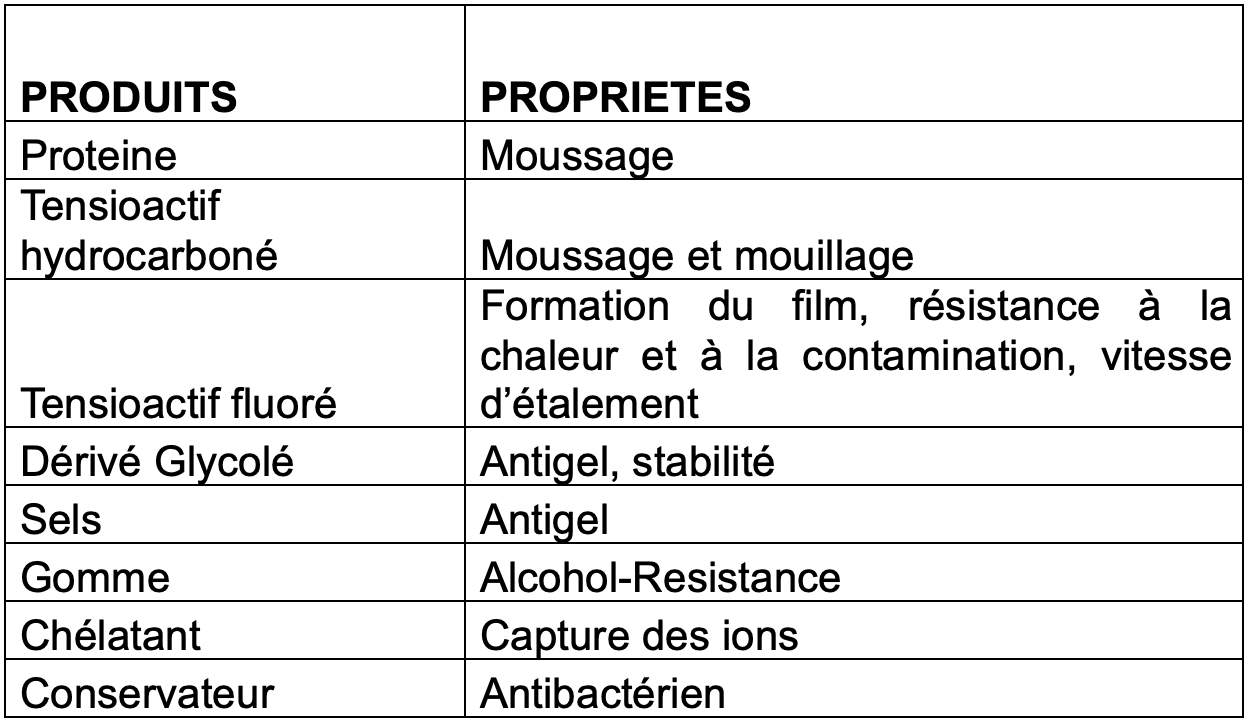
En plus de faire appel aux composés fluorés pour leurs propriétés physico-chimiques exceptionnelles, la formulation des émulseurs mousse contient une gamme d’autres produits chimiques nécessaires pour réaliser l’extinction.
Les principaux composants présents dans les émulseurs avec ou sans tensioactifs fluorés ou polymères fluorés sont les suivants :
Agents moussants :
(a)certains tensioactifs fluorés comme le PFOS et le PFHxS, et leurs dérivés fonctionnels, et des composés fluorotélomères comme le 1157 (perfluoroalkyl bétaïne) et le 1183 (perfluoroalkyl aminoxide) ont été parfois utilisés pour doper le volume de mousse dans des émulseurs AFFF.
(b)Une large palette de tensioactifs hydrocarbonés sont largement utilisés par les fabricants dans tous les types d’émulseurs dits synthétiques : AFFF, AFFF-AR, Synthétique, Classe A et F3. Les agents tensioactifs synthétiques ont pour précurseurs les chaînes d’hydrocarbures (p. ex., CH3(CH2)N-) produits par l’industrie pétrochimique à partir d’huile minérale et/ou d’acides gras animaux et végétaux, qui sont ensuite fonctionnalisés avec un groupe de tête polaire pour obtenir la propriété tensioactive souhaitée, par exemple, le sulfonate d’octyle, CH3(CH2)7SO3-, ou le sulfate de dodécyle, CH3(CH2)11SO4-.
(c)Polymère protéinique : obtenu à partir de l’hydrolyse des déchets d’abattoir ‘’corne et sabot’’, ce procédé désuet et polluant consiste à chauffer la matière première dans des milieux hautement alcalins. La kératine est dégradée en petits fragments de protéines. Le produit fini concentré est parfois contaminé par de l’hémoglobine provenant du sang résiduel, ce qui lui confère une couleur brun foncé très caractéristique. Dans des conditions opérationnelles, la mousse protéinique est typiquement de couleur brunâtre avec une odeur très distinctive, notamment lorsqu’elle est appliquée sur le feu.
Stabilisateurs de mousse : la plupart d’entre eux sont des éthers de glycol. Les plus utilisés sont le butyl glycol, le butyl carbitol et l’hexylène glycol, et plus récemment les éthyl ou butyl propylène glycols. On retrouve parfois des alcools gras de lauryl.
Les agents antigel : le monoéthylène glycol, (CH2OH)2 et le mono-propylène glycol, CH2(CH2OH)2, sont largement utilisés, mais les fabricants utilisent également du chlorure de sodium, de l’urée, etc. dans certaines formulations.
Les glycols et les éthers de glycol présents dans les formulations de mousse sont à des concentrations relativement élevées – généralement de 10 à 20 % – et sont les principaux contributeurs à la valeur de la DBO/DCO.
Autres additifs : dans cette catégorie, les formulateurs utilisent des conservateurs, des produits anticorrosion, des tampons pour stabiliser le pH de la mousse et des agents de chélation pour les ions qui dégradent la performance de la mousse, tous à des niveaux inférieurs à 1%.
Polymères naturels : la gomme de xanthane glucidique est un polymère naturel très commun utilisé pour donner une résistance à l’alcool à la mousse. Appliqué sur une surface de combustible en feu, le polymère précipite et se caractérise par la formation d’une barrière qui résiste à la contamination de la couverture de mousse par le combustible. D’autres polymères et gommes sont également utilisés, comme les celluloses, les alginates, le guar, le caroube ou la carraghénane.
Les tableaux ci-dessous résument les principales propriétés des principaux ingrédients utilisés dans les formulations.
Actuellement, il existe au moins 12 types différents d’émulseur sur le marché, dont certains ont fortement diminué en volume au cours des dernières années.
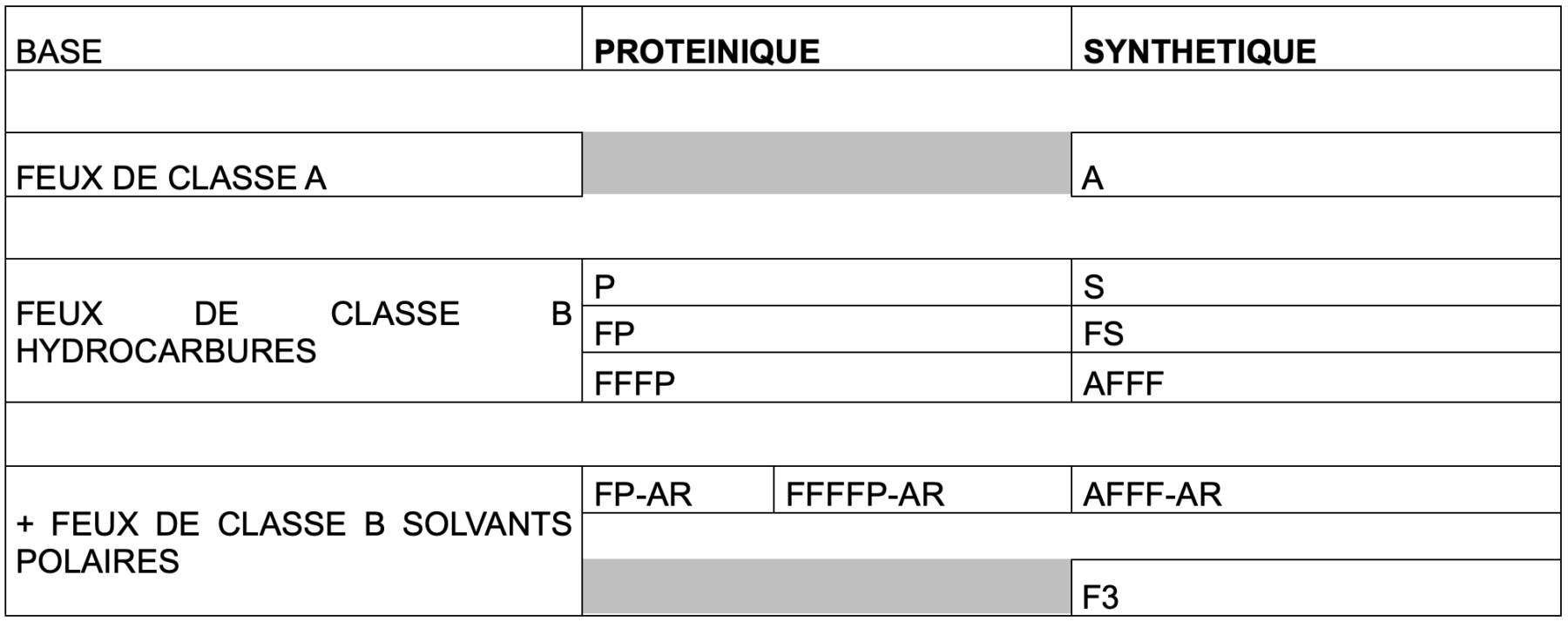
Les risques associés à des risques particuliers varient selon les utilisateurs. Pour choisir l’émulseur adéquat, il est important de faire une évaluation appropriée et suffisante de ces risques particuliers, en veillant à ce que l’émulseur choisi soit ‘’adapté à l’usage’’, puis de suivre les étapes suivantes pendant l’approvisionnement et l’utilisation opérationnelle :
- a) lister l’équipement : s’il s’agit d’un équipement fixe ou mobile, c.‑à‑ un parc de réservoirs, des moniteurs ou des appareils d’incendie ;
- b) vérifier le bon taux de dosage, p. ex., 1 %, 3 % ou 6 %, pour utilisation ;
- c) s’assurer que le taux d’application est juste ;
- d) déterminer la durée d’application de la mousse, la stabilité de la couverture de mousse et le moment où une nouvelle application est nécessaire;
- e) déterminer la disponibilité du soutien possible de sources externes, c.‑à‑ les renforts extérieurs;
- f) connaître la garantie du fabricant et les conditions d’utilisation précisées pour la mousse;
- g) tenir compte des règlements environnementaux locaux – à la fois les changements actuels et futurs.
3F est un fabricant responsable et sera heureux d’aider ses clients dans la définition des risques et le choix d’un émulseur approprié et des équipements associés.
À suivre dans la partie 4.
Des AFFF aux F3 : Chimie – Partie 2
Dans cette partie, nous traitons de la chimie impliquée dans la formulation de mousses de classe A pour les combustibles carbonés, et des mousses AFFF de classe B basées sur la chimie du PFOS pour les incendies d’hydrocarbures liquides et de solvants polaires.
Dans la première partie de cette série d’articles, nous avons vu que les mousses anti-incendie AFFF contiennent diverses substances perfluoroalkyl (PFAS); cependant, la mousse anti-incendie n’est qu’une des nombreuses applications des PFAS.
Les PFAS sont utilisés depuis des décennies dans plus de 200 autres applications industrielles et domestiques, telles que l’emballage alimentaire, le traitement du cuir et des textiles, la protection antitaches des tapis et des vêtements, les détergents, l’imperméabilisation à l’eau et à l’huile, les peintures et les vernis, les encres d’imprimerie, le chromage, les vêtements d’extérieur et de protection (EPI) pour les services d’urgence et militaires. Ces substances perfluorées sont largement utilisées car elles offrent une combinaison de propriétés uniques, y compris la capacité de repousser l’eau (hydrophobie), la capacité de repousser les huiles (oléophobie), la capacité de réduire la tension superficielle des solutions aqueuses à moins de 20 dynes/cm et avec elle agissant comme détergents, émulsifiants, agents mouillants et dispersants.
L’OCDE (2021) a récemment clarifié la définition de ce qui constitue un PFAS, tout en reconnaissant, selon Buck et coll. (2011), les éléments suivants :
« Les PFAS sont définies comme des substances fluorées s’ils contiennent au moins un atome perfluoré de carbone de méthyle ou de méthylène (sans atome H/Cl/Br/I attaché à celui-ci),c’est-à-dire, à quelques exceptions près, que tout produit chimique ayant au moins un groupement méthyle perfluoré (–CF3) ou un
groupement méthylène perfluoré (–CF2–) est un PFAS. »
Plus de 800 produits actuellement disponibles sur le marché ont été identifiés, mais la véritable liste des PFAS utilisés dans le commerce et l’industrie est susceptible d’être de 10000 ou plus; la Convention de Stockholm des Nations Unies a répertorié 4700 substances liées au PFOA seul. Les PFAS ont commencé à être fabriqués en grandes quantités au début des années 50. Tous sont anthropiques créés par l’homme à l’aide de la synthèse chimique et ils n’existent pas naturellement. Les produits finaux perfluorés extrêmement stables, résistants aux produits chimiques et à la dégradation dans l’environnement ont longtemps été identifiés comme des « produits chimiques éternels », par exemple par des scientifiques et des journalistes comme Rebecca Renner [« Growing Concern Over Perfluorinated Chemicals » (2001) Environ. Sci. Technol. 35(7) 154A-160A; « The long and the short of perfluorinated replacements » (2006) Environ. Sci. Technol. 40(1) 12-13] or Sharon Lerner writing in the Intercept [« Toxic Chemicals Discovered in Hundreds of Products » Sharon Lerner (The Intercept, décembre 2020)].
Il faut souligner que, bien que les PFAS soient encore communément et incorrectement appelés ‘’contaminants émergents’’, ils sont vraiment devenus des contaminants préoccupants depuis au moins 10 ans et ne devraient plus être qualifiées de ‘’nouveaux’’. D’autre part, la technologie pour traiter les résidus de PFAS est actuellement encore émergente et en développement.
Les mousses anti-incendie sont dites de classe A pour les feux de combustibles carbonés tels que le bois, le papier ou la végétation, agissant comme agents mouillants améliorant la pénétration de l’eau dans les incendies en profondeur et ne contiennent pas de tensioactifs fluorés, seulement des tensioactifs dhydrocarbonés; ou, d’autre part, les mousses de classe B sont spécifiquement formulées pour les hydrocarbures liquides tels que l’essence et les solvants polaires tels que l’éthanol. Les mousses modernes de classe B peuvent contenir soit des tensioactifs fluorés et être capables de formation de film à l’interface air-carburant (AFFF), soit des mousses F3 sans fluor, spécialement formulées contenant uniquement des tensioactifs hydrocarbonés. Il est intéressant de noter que les mousses sans fluor de classe B (F3) peuvent être utilisées efficacement pour les feux de classe A et de classe B, contrairement aux AFFF.
Additifs de classe A pour combustibles carbonés
Les mousses anti-incendie de classe A sont largement utilisées dans le monde entier, en particulier en Australie, en Amérique du Nord et en Europe du Sud, pour les incidents impliquant des combustibles carbonés, par exemple les incendies de bâtiments, les dépôts de plastique et de pneus, ainsi que les prairies et les feux de forêts. Ted Schaefer ,travaillant alors pour 3M Australie à la fin des années 1980, a mis au point l’une des premières mousses efficaces de classe A, ‘’3M Fire-Brake BFFF’’, reconnue en 2001 par l’Académie australienne des sciences technologiques et de l’ingénierie comme l’une des 100 meilleures inventions australiennes du XXe siècle.
Les mousses de classe A se comportent très différemment des AFFF contenant des tensioactifs fluorés, car elles sont spécifiquement formulées pour pénétrer efficacement les combustibles carbonés, tels que la végétation compactée, le papier ou le bois, en utilisant des tensioactifs hydrocarbonés spéciaux, peu différents à voir avec un détergent ménager. Les AFFF avec tensioactifs fluorés, conçus pour l’application en surface sur des incendies d’hydrocarbures liquides ou de solvants polaires, sont loin d’être aussi efficaces pour pénétrer aussi profondément les substrats solides. Il est franchement trompeur d’entendre certains membres de l’industrie affirmer que leurs produits AFFF peuvent être utilisés comme émulseurs de classe A et de classe B.


Mister H: Pénétration avec du Classe A. Mister F: Impossibilité à pénétrer avec du Classe B AFFF
(Bluteau 2007)
Le comportement différent d’un additif de classe A à base de tensioactifs hydrocarbonés et d’un AFFF fluoré de classe B vis-à-vis d’un combustible carboné peut être mis en scène dans ce dessin utilisé pour la première fois par l’un d’entre nous en 2007. Mister H, une véritable mousse de classe A peut pénétrer dans le carburant carboné en raison de ses caractéristiques de mouillage optimisées ; Mister F, un tensioactif fluoré de base d’AFFF, ne peut pas pénétrer en raison de ses propriétés hydrophobes et oléophobes.
Emulseur AFFF de classe B pour hydrocarbures liquides et solvants polaires
Le premier rapport sur une mousse AFFF, appelée LightWater®, par R.L. Tuve et al, du Laboratoire de recherche navale et de la société 3M, en mars 1964, fait état d’une mousse capable d’éliminer l’évaporation et de former un film à la surface de combustibles inflammables à bas point d’éclair tels que l’essence, et démontre qu’il est 1200% plus efficace que les mousses protéiniques standard dans des conditions identiques.
Les composés utilisés dans les formulations d’émulseurs de 3M appartenaient à la classe générale des dérivés de l’acide perfluorosulfonique, certains étant des sels quaternaires, d’autres étant des alcools, des esters, des sels anioniques d’acides sulfonamido carboxyliques substitués, etc. Tous ces composés sont hydrosolubles, Les fluorocarbures de poids moléculaire élevé ont montré un abaissement de la tension superficielle de l’eau à moins de 20 dynes/cm. En général, ils sont insensibles aux électrolytes et montrent une activité superficielle lorsqu’ils sont dissous dans des solvants organiques.
Le premier brevet pour un AFFF a été accordé à Richard Tuve et Edwin Jablonski en juin 1966 [1], représentant une nouvelle ère dans les émulseurs de lutte contre les incendies qui devait durer 30 à 40 ans jusqu’à ce que la 3M Company Minnesota se retire complètement de la chimie à base de PFOS en mai 2000.
Les informations de la littérature existante dans les brevets donnent un aperçu fascinant des dérivés utilisés dans ces premiers AFFF. Des dérivés du perfluorooctane sulfonamide (PFOSA) et de l’acide perfluorooctane carboxylique (PFOA) ont été utilisés. Comme l’indique le brevet de 1966, ces premières formulations comprennent les sels d’ammonium quaternaire du PFOS et des dérivés amido du PFOA :
C8F17-SO2NH2-(CH3)3N(CH3)3+I–
C7F15-CONH-(CH3)3N(CH3)3+I–
un dérivé amphotère du PFOA à base d’aminobétaïne
C7F15-CONH-(CH2)3–N+(CH3)2-CH2-CH2-COO–
et le sel de potassium d’un dérivé sulfamide de PFOS
C8F17SO2N(C2H5)-CH2COOK
Le sel de potassium du PFOS sous forme de tensioactif FC-95 a également été utilisé dans les premiers émulseurs.
Il est intéressant de noter que quelques 50 ans plus tard, Barzen-Hanson et al en 2017 [2] du groupe de Jennifer Field à l’Université d’État de l’Oregon a identifié une vaste gamme d’autres dérivés, ou leurs produits de décomposition, impliquant 40 classes différentes dans les anciens AFFF.
Fluoration électrochimique (ECF) – le procédé Simons
La société 3M a annoncé en mai 2000 qu’elle éliminait progressivement la production de tensioactifs fluorés sur base de PFOS et qu’elle se retirait entièrement du marché des émulseurs AFFF, ce qui marquait la fin de la disponibilité des produits Light Water™ et Light Water™ ATC™ (3M Company (2000)). Parmi les autres produits utilisant le PFOS, mentionnons les traitements antitaches ScotchGuard et hydrofuges. On pense que la production de PFOS par la société 3M a complètement cessé vers 2002, étant remplacée par le composé à chaîne plus courte PFBS – C4-, alors que la production de PFOS et de PFHxS se soit poursuivie depuis en Chine et en Inde.
Jusqu’en 2000, le PFOS était fabriqué selon le procédé de fluoration électrochimique ECF de Simons (3M Company, 1999; Ignat’ev et coll., 2009; Sartori et Ignat’ev, 1998). Ce procédé consiste à remplacer les atomes d’hydrogène de l’octyl sulfonate par l’utilisation électrolytique du fluorure d’hydrogène afin de produire du fluorure de perfluorooctane sulfonyle, le PFOSF.
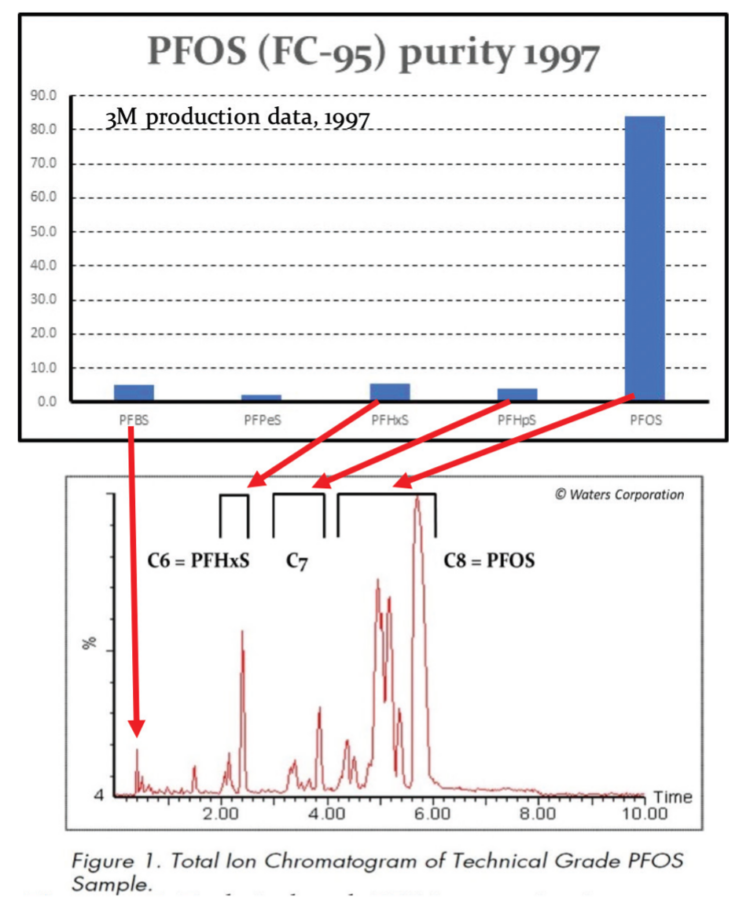
C8H17SO3H + HF ==>> C8F17(C=O)F
Le PFOSF est un fluorure d’acyle hautement réactif qui sert de base à la préparation de dérivés du PFOS comme le sulfonamide PFOSA ou le N-éthyl-PFOSA, par exemple :
C8F17(C=O)F + C2H5NH2 ==>> C8F17(C=O)-NH-C2H5
La production de PFOSF à l’aide de la fluoration électrochimique ECF était, et demeure, un procédé intrinsèquement ‘’sale’’ qui a donné lieu à une vaste gamme d’isomères structuraux, à chaîne droite et ramifiés avec CF-CF3 et C-(CF3).2 chaînes latérales, ainsi que des homologues de longueur de chaîne impaire et uniforme tels que C4 PFBS, C6 PFHxS et C7 PFHpS. Par conséquent, le PFOS de qualité technique a toujours été et continue d’être contaminé par un pourcentage important de PFHxS. De plus, les chaînes perfluoroalkyles du PFOS et du PFHxS peuvent former des hélices gauches ou droites qui donnent des pseudo-racémates qui ont été détectées dans les sérums humains (Wang et al., 2011; Naile et al., 2016; Sasaki et al., 2018).
Citation de la proposition de restriction du PFHxS par l’ECHA (13 juin 2019) :
« … Des sources indiquent que lors de la fabrication de composés perfluorés, un mélange de composés de longueur de chaîne variable se forme habituellement, avec des quantités typiques de PFHxS formées lors de la fabrication de PFOS se situant entre 4 et 14 % (BiPRO, 2018) citant (Ren, 2016). Ces chiffres sont étayés par les mesures de PFHxS dans les produits commerciaux à base de PFOS, à savoir de 3,5 % à 9,8 % dans le FC-95 de 3M (BiPRO, 2018) citant 3M (2015) et de 11,2 % à 14,2 % dans trois produits de Chine (Jiang et al, 2015). La BiPRO note toutefois que la quantité de composant C6 peut être réduite par la purification à différents stades de la chaîne de production… »
L’utilisation du procédé ECF pour produire des acides sulfoniques et carboxyliques perfluorés, tels que les PFOS et PFOA et leurs dérivés, a été résumée par Buck et al [2011], comme indiqué ci-dessous.
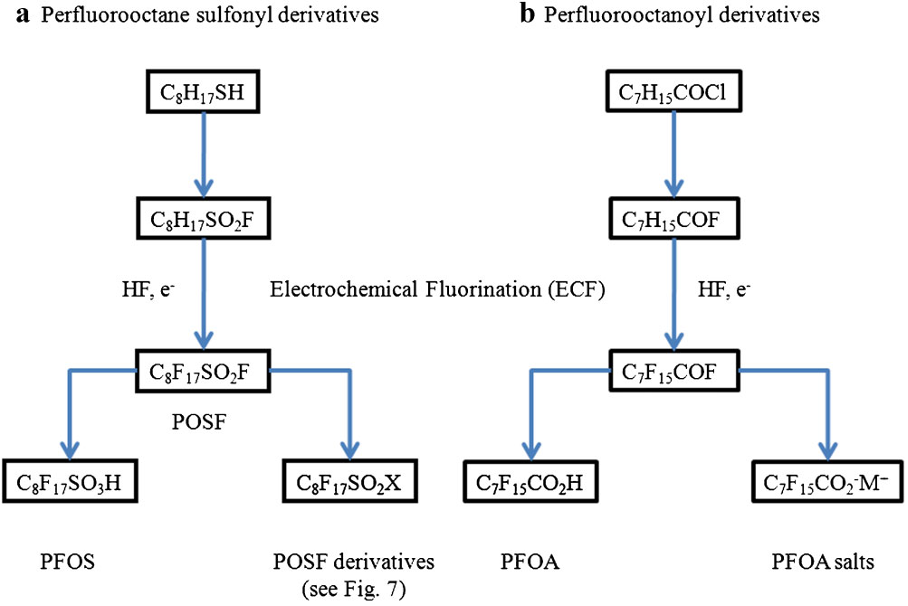
source: Buck et al (2011)
A suivre dans la partie 3.
Références
Barzen-Hanson, K.A., Roberts, S.C., Choyke, S., Oetjen, K., McAlees, A., Riddell, N., McCrindle, R., Ferguson, P.L., Higgins, C.P., and Field, J.A.. (2017) “Discovery of 40 Classes of Per- and Polyfluoroalkyl Substances in Historical Aqueous Film-Forming Foams (AFFFs) and AFFF-Impacted Groundwater” Environ, Sci. Technol. 51, 2047-2057.
Benskin J.P., De Silva A.O., Martin J.W. (2010) Isomer Profiling of Perfluorinated Substances as a Tool for Source Tracking: A Review of Early Findings and Future Applications. Rev. Environ. Contam. Toxicol.:111-160.
Buck, R.C., Franklin, J., Berger, U., Conder, J.M., Cousins, I.T., de Voogt, P., Jensen, A.A., Kannan, K., Mabury, S.A., and van Leeuwen, S.P.J. (2011) Perfluoroalkyl and polyfluoroalkyl substances in the environment: terminology, classification, and origins. Integr. Environ. Assess. Manag. 7(4), 513-541.
Ignat’ev, N.V., Willner, W., and Sartori, P. (2009) Electrochemical fluorination (Simons process) – A powerful tool for the preparation of new conducting salts, ionic liquids and strong Brǿnsted acids. J. Fluorine Chem. 130(12), 1183-1191.
Naile, J., Garrison, A.W., Avants, J.K., and Washington, J.W. Isomers/Enantiomers of Perfluorcarboxylic Acids: Method Development and Detection in Environmental Samples. Chemosphere 44, 1722-1728.
OECD (2021), Reconciling Terminology of the Universe of Per- and Polyfluoroalkyl Substances:
Recommendations and Practical Guidance, OECD Series on Risk Management, No. 61, OECD
Publishing, Paris.
Sartori, P. and Ignat’ev, N.V. (1988) The actual state of our knowledge about mechanism of electrochemical fluorination in anhydrous hydrogen fluoride. J. Fluorine Chem. 87(2(, 157-162.
Sasaki, T., Egami, A., Yajima, T., Uekusa, H., and Sato, H. (2018) Unusual Molecular and Supramolecular Structures of Chiral Low Molecular Weight Organochelators with Long Perfluoroalkyl Chains. Crystal Growth and Design 18(7) 4200-4205.
Tuve, R.L. amd Jablonksi, E.J. (1966) US 3,258,423 Patent June 28, 1966 “Method Of Extinguishing Liquid Hydrocarbon Fires”, assignors to the United States of America as represented by the Secretary of the Navy. Filed Sept. 4, 1963, Ser. No. 306,665.
Vyas, S.M., Kania-Korwel, I., Lehmler, H.J. (2007) Differences in isomer composition of perfluorooctanoylsulfonyl (PFOS) derivatives. J. Environ. Sci. Health and Toxic Hazard Substance Environ. Eng. 42, 249-255.
Wang, Y., Beeson, S., Benskin, J.P., De Silva, A.O., Genuis, S.J., and Martin J.W. (2011) Enantiomer Fractions of Chiral Perfluoroctanesulfonate (PFOS) in Human Sera. Environ. Sci. Technol. 45(20) 8907-8914
Des AFFF aux F3 : Histoire – Partie 1
La chimie moderne a créé plusieurs centaines de milliers de composés chimiques, que nous rencontrons dans le cadre de notre vie quotidienne. En effet, il serait très difficile de passer une journée sans être en contact avec une classe de molécules – les substances perfluoroalkyles ou PFAS – qui ont été exploitées commercialement depuis la fin de la Seconde Guerre mondiale au cours des 75 dernières années.
Même si nous pouvions qualifier la chimie comme un miracle de la science, il vaut la peine de savoir que la chimie a été abordée par les Égyptiens 3000 ans avant JC, et a ensuite été étudiée par les Grecs anciens qui ont décrit la combinaison des 5 éléments : terre, air, feu, eau et éther. Cette théorie a été largement acceptée pendant plus de 1000 ans.
La base de la chimie moderne, telle que nous la comprenons maintenant, a été établie au cours des trois cents dernières années. La nature de l’atome, l’identification des composés atomiques, la première synthèse moderne a été réalisée.
En 1906, Frédéric Henri Moissan (1852-1907), chimiste français travaillant à Paris à l’École Supérieure de Pharmacie, isole pour la première fois le fluor élémentaire, F2, une découverte pour laquelle il reçoit le prix Nobel de chimie en 1906. Le fluorure d’hydrogène obtenu à partir du spath fluor avait été identifié par le célèbre chimiste suédois Karl Wilhelm Scheele quelques années plus tôt.
Après la Première Guerre mondiale et au milieu des années 1930, l’industrie chimique allemande connut son apogée, notamment en ce qui concerne les nouveaux colorants synthétiques. La chimie du fluor a commencé à avoir un rôle commercial – un colorant rouge Naphtol AS, utilisé comme couleur rouge officielle du drapeau nazi, et Indanthrene Blue utilisé comme composant de ‘’Flieger Grau’’ ou ‘’Gris Pilote’’, la couleur bleu-gris des uniformes de la Luftwaffe, tous deux contenant un groupement méthyle fluoré CF3 qui aide à prévenir la décoloration. Les sous-traitants travaillant pour DuPont ont produit le premier tissu industriel entièrement synthétique, le nylon polymère. Depuis lors, les chimistes n’ont jamais cessé d’inventer de nouveaux composés !
Lorsque nous pensons aux produits chimiques, il est important de savoir que beaucoup, sinon la plupart des composés synthétiques actuellement disponibles dans le commerce sont produits par l’industrie pétrochimique. Depuis l’invention du moteur à combustion interne, l’essence et les produits pétroliers sont devenus de plus en plus importants pour de nombreuses activités humaines, mais sont associés à un risque élevé d’incendie.
La nature de ce risque a fait ressortir la nécessité de s’attaquer à ces incendies souvent catastrophiques. Au début des années 40, on a mis au point de la mousse protéinique à base de cornes et de sabots, un déchet d’abattoir, pour lutter contre les feux d’hydrocarbures de classe B, par exemple ceux qui impliquent du pétrole, de l’essence, du carburant d’avion et des solvants.
En 1949, la société 3M Minnesota a industrialisé le procédé de fluoration électrochimique -ECF- de Simons pour la fabrication de composés perfluorés -PFC- tels que les amines perfluorées, acides carboxyliques et sulfoniques dans lesquels les hydrogènes de la chaîne alkyle-carbone ont été totalement remplacés par du fluor. Joseph Simons avait découvert le procédé ECF alors qu’il travaillait au Pennsylvania State College dans les années 1930, mais n’a pu publier ses travaux qu’après la Seconde Guerre mondiale car la chimie du fluor était essentielle pour la purification de l’uranium dans le cadre du projet Manhattan.
En 1953, la structure de Scotchgard a été découverte accidentellement par Patsy Sherman et Sam Smith travaillant pour la société 3M en travaillant sur un caoutchouc pour les lignes de carburéacteur. Trois ans plus tard, en 1956, la société 3M lance Scotchguard sur le marché. Ce traitement du tissu, du textile et du cuir est basé sur un dérivé du PFOS contenant du N-éthyl-PFOSA et donne une protection contre les taches d’eau, d’huile et d’autres liquides à la fibre traitée.
Fait intéressant, le N-éthyl-PFOSA, connu sous le nom de sulfluramide, a été développé à l’origine pour tuer les fourmis, les cafards et les termites, et est encore utilisé à ce jour comme insecticide sulfluramide contre les fourmis coupantes de feuilles au Brésil. Le sel de lithium du PFOS a été mis au point pour tuer les guêpes et les frelons, mais il est très toxique pour les abeilles domestiques.
Le PFOS, l’acide perfluorooctane sulfonique et ses dérivés deviennent par la suite cruciaux pour le développement de mousses de formation de film aqueux -AFFF- de classe B efficaces contre les incendies d’hydrocarbures liquides et de solvants.
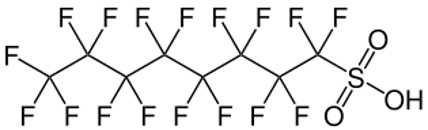
Figure 1. La structure du PFOS, PerFluoroOctyl Sufonic Acid.
Au cours des années 1960, le laboratoire de recherche navale du département américain de la marine, en collaboration avec la société 3M, a commencé à développer des mousses anti-incendie à base de PFOS. Un brevet pour la mousse anti-incendie AFFF a été délivré en juin 1966 pour l’extinction des incendies d’hydrocarbures liquides.
À la fin des années 60, une série d’incendies majeurs de carburant se produisent à bord des navires de la marine américaine, causant d’importantes pertes de vie et des dommages :
(i) 1966 : USS Oriskany – le feu tue 44 marins.
(ii) 1968 : USS Forrestal – en service actif dans le golfe du Tonkin pendant la guerre du Vietnam, la défaillance et tir accidentel d’une fusée de chasse Zuni sur le pont d’envol de ce super-porte-avions a provoqué un incendie catastrophique de carburant d’aviation qui a coûté la vie à 134 membres d’équipage, en a blessé beaucoup d’autres, détruit près de 50 aéronefs, causé 72 millions de dollars de dommages et laissé le navire inapte au service actif.

1969: USS Enterprise – Un feu à bord tua 28 marins.
Ces incendies majeurs ont incité le département américain de la marine à rendre obligatoire l’utilisation de la mousse anti-incendie AFFF récemment développée, que la société 3M fabriquait pour l’armée américaine.
Les composés perfluorés ont été utilisés avec succès pour créer l’AFFF, et les marques LightWater® et ATC® résistantes à l’alcool à base de PFOS de 3M sont devenues le produit de référence pour les feux d’hydrocarbures des années 1970 jusqu’en mai 2000, lorsque la Société annonça qu’elle éliminait progressivement la chimie des PFOS pôur des considérations environnementales. L’AFFF avait en effet conquis le monde de la lutte contre les incendies et était considérée depuis des décennies comme la réponse ultime pour l’extinction des grands incendies d’hydrocarbures à usage militaire et civil, en particulier par les industries aéronautique et pétrochimique.
Dans les années 70, une technologie alternative a été développée basée sur le processus de télomérisation. Cette technologie a fourni une alternative au procédé ECF et a introduit une nouvelle classe de produits chimiques perfluorés sur le marché. Alors que le procédé ECF produisait principalement du PFOS contaminé par des homologues impairs et même numérotés du PFOS comme le PFHxS (~5‑8 % p/p), perfluorohexane Sulfonic Acid, ainsi que des isomères à chaîne ramifiée, la télomérisation ne produisait que des chaînes carbonées alykes linéaires. La caractéristique des dérivés fluorotélomères est une fraction perfluoroalkyl liée par un groupe de diméthylène -CH2-CH2- à un groupe fonctionnel qui pourrait être négatif (anionique), positif (cationique) ou à la fois négatif et positif (amphotère).
La plupart des mousses anti-incendie AFFF modernes à base de télomères fluorés, connues sous le nom de ‘’mousses C6 pures’’, sont basées sur des dérivés de l’acide sulfonique fluorotélomère 6:2 (6:2FTS), ou un analogue du thioéther, contenant une chaîne de perfluoroakyle C6 liée par -(CH2)2- à un groupe fonctionnel chargé. Le 6:2FTS contient une chaîne de C8 et sa structure est illustrée ci-dessous.
Sa similitude avec le PFOS est claire, mais les groupes de CH2 font en sorte qu’il se comporte très différemment en ce qui concerne son profil de PBT. Toutes les fractions de perfluoroalkyle ou leurs produits de dégradation sont extrêmement persistants sur le plan environnemental (vP)., mais avec un potentiel de bioaccumulation ou de toxicité différent.
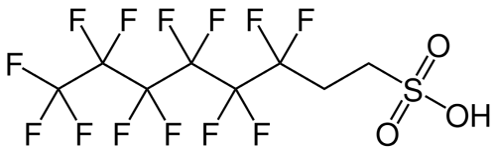
Figure 2. Structure du 6:2FTS
Les premiers émulseurs à base de télomères fluorés, cependant, contenaient à la fois 6:2FTS et souvent des quantités substantielles de dérivés 8:2FTS. Il s’agissait d’un problème, car le 8:2FTS pouvait être dégradé en un produit fini stable, l’acide perfluoroctanoïque ou l’PFOA, qui a une toxicité importante. Ce problème a maintenant été essentiellement résolu grâce au Programme ‘’StewardShip PFOA 2010-2015’’ de l’industrie, dont les concentrations résiduelles de PFOA ou de ses précurseurs ont été réduites à moins de 25 parties par milliard (ppb).
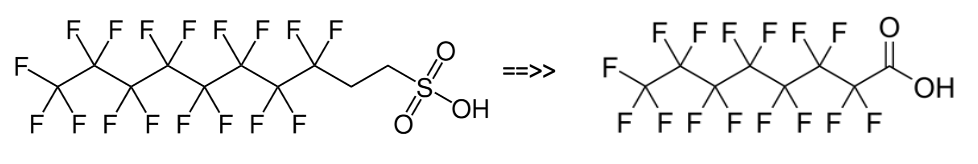
Figure 3. 8 : Décomposition du 6:2FTS en PFOA
Des années 1970 à la fin des années 1990, de nombreux fabricants de mousse anti-incendie sont apparus sur le marché, développant et offrant une large gamme de mousses différentes pour les utilisateurs. Il s’agissait notamment de mousses de classe B AFFF, AFFF-AR (résistant à l’alcool), de protéines filmogènes (FFFP) et de protéines fluorées (FP). Des mousses de classe A spécifiquement conçues pour les feux de solides tels que les habitations ou les feux de forêts ont également été développées au cours de cette période.
Le 16 mai 2000, la société 3M a brusquement annoncé la suppression progressive de son activité dans la chimie du fluor –PFOS- , affectant non seulement la production des mousses anti-incendie, mais aussi une large gamme de produits domestiques et commerciaux. Cette annonce était justifiée en ce qui concerne la responsabilité de l’entreprise à l’égard de l’environnement, car il a été confirmé que les substances perfluoroalkyl en C8 (PFAS) fabriquées à l’aide de la technologie ECF représentaient une menace pour l’environnement avec une pollution qui s’était propagée dans le monde entier, affectant un large éventail de compartiments environnementaux ainsi que le biote, y compris l’homme.
Au cours des deux ou trois années suivantes, l’entreprise a cessé toutes les activités liées à la chimie du PFOS, avec un retrait total du marché des mousses de lutte contre les incendies, en proposant – sans succès -un remplacement par une chimie à chaîne plus courte à base de PFBS – perfluorobutyl Sulfonic Acid). Cependant, la production de composants à base de PFOS et du PFHxS à l’aide du procédé ECF se poursuit en Chine et en Inde.
Avec le retrait de 3M et l’élimination progressive de la chimie du PFOS du marché des mousses anti-incendie, d’autres grands fabricants de produits chimiques fluorés PFAS et de mousse anti-incendie ont souligné qu’ils considéraient que la chimie des télomères fluorés était « sûre » et en fait respectueuse de l’environnement, car elle n’avait rien à voir avec la chimie ECF et que les produits ne pouvaient contenir ni PFOS ni PFOA. Le marché des mousses anti-incendie a basculé vers les produits AFFF à base de fluorotélomères au cours des années 2000-2010.
À partir de 2002, un débat animé et parfois acrimonieux a eu lieu entre les fabricants de PFAS et d’AFFF – sous les auspices d’une association commerciale, la Fire Fighting Foam Coalition (FFFC), financés principalement par le lobby de la chimie du fluor – et les fabricants indépendants, en particulier de mousses sans fluor F3, les organismes de réglementation et les experts scientifiques du milieu universitaire. Cette discussion a donné lieu à une série de séminaires internationaux, de conférences ainsi qu’à des centaines de publications dans la littérature évaluée par des pairs sur les conséquences environnementales du remplacement du PFOS par des télomères fluorés. À cette époque, le principal forum international pour discuter des développements de la technologie des mousses anti-incendie s’est avéré être la série de conférences Reebok sur la mousse, tenues à Manchester et à Bolton au Royaume-Uni en 2002, 2004, 2007, 2009 et 2013.
À partir de 2002, un certain nombre de petits fabricants indépendants de mousses ont commencé à offrir des mousses expérimentales de classe B sans fluor d’hydrocarbures liquides -F3- de première génération comme alternatives plus durables pour l’environnement aux mousses contenant des PFAS. Au cours des dix années qui ont suivi, le débat a fait rage grâce aux études scientifiques publiées qui ont conclu que la chimie des télomères représentait une menace pour l’environnement. Les premières formulations de télomères étaient des mélanges de dérivés 6:2 et 8:2. Il a été démontré que le matériau 8:2 est un précurseur potentiel pour la production de PFOA (acide perfluorooctanoïque ou C8) extrêmement persistant dans l’environnement par dégradation, qui est par la suite associée à des effets à long terme sur la santé. À l’époque, cela a été vigoureusement contesté par les représentants de l’industrie chimique du fluor participant aux conférences Reebok.
Toutefois, en raison des pressions exercées par l’EPA des États-Unis, de nombreux grands fabricants de matières premières ont adopté le Programme ‘’stewardship PFOA 2010-2015’’ visant à réduire l’utilisation du PFOA et de ses précurseurs. Les améliorations apportées à la purification des dérivés des télomères fluorés ont permis de réduire le nombre de matières apparentées au PFOA à moins de 25 ppb, ce qui a permis d’obtenir des dérivés des télomères fluorés dits ‘’purs C6’’. Le Programme ‘’Stewardship’’ a mené à un changement dans les formulations de mousse contenant auparavant des télomères fluorés C6/C8 en un substitut dit « drop in » contenant principalement des télomères fluorés C6.
Malheureusement, ce changement n’était pas aussi simple qu’il était censé l’être et les fabricants de mousse ont dû reformuler et augmenter la teneur totale en PFAS C6 pour atteindre une performance similaire à celle des formulations précédentes C6 / C8. Les utilisateurs finaux n’ont même pas été informés de ce changement !
À peu près au même moment, les études scientifiques ont accumulé des preuves que même le C6 hyper-pur n’était PAS une alternative appropriée, mais une « substitution regrettable » et le débat est passé à un autre niveau. 2015 a marqué un changement radical dans le débat sur les PFAS. L’industrie de la chimie du fluor et les organismes de réglementation n’ont plus nié la toxicité du PFOA et la question a été portée à l’attention du public par des journalistes scientifiques.
Une série de déclarations publiques signées par des scientifiques du monde entier – la Déclaration d’Helsingør 2014, la Déclaration de Madrid 2014 et la Déclaration de Zürich 2018 – ont soulevé des préoccupations concernant l’utilisation continue des PFAS et en tant que principaux polluants planétaires et leur impact à long terme sur l’environnement. Une publication majeure en 2020 a suggéré que tous les PFAS soient traités comme une seule classe chimique en raison de leurs problèmes environnementaux communs plutôt que comme des produits chimiques individuels.
La Convention de Stockholm des Nations Unies et son Comité d’examen des polluants organiques persistants (CEPOP) ont ajouté le PFOS, le PFHxS et le PFOA aux annexes appropriées interdisant ou limitant leur utilisation (2018-2022).
Des pays tels que l’Allemagne et la Norvège, ou des États individuels tels que le Queensland en Australie, ont été à l’avant-garde de la réglementation de l’utilisation des PFAS, en particulier pour une utilisation hautement dispersive comme les mousses anti-incendie.
Certains pays n’attendent pas les décisions de l’ONU pour réglementer l’utilisation des PFAS. En Europe, le PFOS est interdit depuis 2011 et le PFOA depuis 2018; les discussions en cours visent à arrêter complètement l’utilisation de tous les PFAS avec des carbones C4 à C20 avec pour date limite 2025 ; en prévision de ces restrictions, de nombreuses industries adoptent la technologie sans fluor. Aux États-Unis, le changement est principalement poussé par le coût des litiges avec des milliers de procès en cours contre l’industrie chimique du fluor et les fabricants de mousse.
À suivre dans la partie 2
